题目内容
8.H2SO4的摩尔质量为98g/mol,在500mL 1mol/L H2SO4溶液中,溶质的质量为49g.分析 摩尔质量是单位物质的量的物质的质量,单位为g/mol,溶液中溶质n=CV=$\frac{m}{M}$计算数据计算得到.
解答 解:硫酸H2SO4的摩尔质量=(1×2+32+4×16)g/mol=98g/mol,在500mL 1mol/L H2SO4溶液中溶质硫酸物质的量=0.500L×1mol/L=0.5mol,
溶质硫酸的质量=0.5mol×98g/mol=49g;
故答案为:98g/mol;49g.
点评 本题考查了摩尔质量的概念应用,主要是溶液中溶质物质的量和质量的计算,掌握概念理解实质是解题关键,题目较简单.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
18.下列结论正确的是( )
①离子还原性:S2->I->Fe2+>Br-
②氢化物沸点HF<HCl<HBr
③酸性:H2SO4>HClO4
④非金属性:F>Cl>S.
①离子还原性:S2->I->Fe2+>Br-
②氢化物沸点HF<HCl<HBr
③酸性:H2SO4>HClO4
④非金属性:F>Cl>S.
| A. | ②④ | B. | ①④ | C. | ①②③ | D. | 只有④ |
16.下列Cl2既表现氧化性又表现还原性的反应是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Cl2+H2O═HCl+HClO | ||
| C. | Cl2+Cu$\frac{\underline{\;点燃\;}}{\;}$CuCl2 | D. | Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
2.在某温度下,工业合成氨反应N2+3H2 $?_{催化剂}^{高温、高压}$2NH3(正反应放热),把氮气和氢气以1:1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器的容积固定),在保持相同温度的条件下,A、B两个容器的合成氨反应先后达到平衡状态.请回答:
(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
达平衡时,容器A中N2的转化率为10%,容器B中M(平)为18.75,容器A(选填“A”或“B”)体积更大.
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
| 容器A | 容器B | |
| M(平) | 16.7 | |
| 平衡时N2的转化率 | 20% |
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
| 化学式 | 电离常数(298K) |
| 氢氰酸 | K=4.5×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
7.下列说法正确的是( )
| A. | 氧化还原反应的特征是电子的转移 | |
| B. | 物质中某元素失去电子,则此物质是还原剂 | |
| C. | 有单质参与的反应一定是氧化还原反应 | |
| D. | 同种元素的价态越高,其氧化性一定越强 |
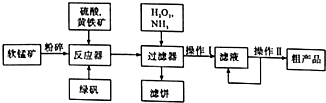 硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下: