题目内容
2.在某温度下,工业合成氨反应N2+3H2 $?_{催化剂}^{高温、高压}$2NH3(正反应放热),把氮气和氢气以1:1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器的容积固定),在保持相同温度的条件下,A、B两个容器的合成氨反应先后达到平衡状态.请回答:(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
| 容器A | 容器B | |
| M(平) | 16.7 | |
| 平衡时N2的转化率 | 20% |
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
| 化学式 | 电离常数(298K) |
| 氢氰酸 | K=4.5×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
分析 (1)平衡常数是:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比;平衡常数只受温度影响,温度相同,则平衡常数相等;
(2)平衡常数只受温度影响,正反应为放热反应,欲增大该反应K值,只能是降低温度使平衡正向移动;
(3)设氮气、氢气均为1mol,A中平衡时M(平)=16.7,则混合气体总物质的量为$\frac{1mol×28g/mol+1mol×2g/mol}{16.7g/mol}$≈1.8mol,混合气体减小2mol-1.8mol=0.2mol,由方程式中气体差量可知消耗的氮气为0.2mol×$\frac{1}{2}$=0.1mol,进而计算氮气转化率;
B中平衡时氮气转化率为20%,则转化的氮气为0.2mol,由方程式中气体差量可知混合气体减小物质的量为0.2mol×2=0.4mol,故混合气体总物质的量为2mol-0.4mol=1.6mol,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均相对分子质量;
B中转化反应物转化率程度大,说明B中正向进行程度大,则起始时B中压强应小于A中,恒温下,压强与体积成反比;
(4)0.1mol/L的氨水溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,由于Kw=c(H+)×c(OH-)=10-14,联立可得:c(OH-)=10-3mol/L,电离的氨水浓度为10-3mol/L,进而计算NH3•H2O的电离度;溶液中水电离的氢氧根离子浓度等于溶液中氢离子浓度;再向溶液中加水稀释到1L,碱性减弱,溶液中氢离子浓度增大,氢氧根离子浓度减小;
(5)由电离常数可知,酸性:CH3COOH>H2CO3>HCN>HCO3-,酸性越弱对应盐的水解程度越大,溶液pH越大;NaCN溶液中通入少量CO2气体生成HCN与NaHCO3.
解答 解:(1)N2+3H2?2NH3的平衡常数K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$;A、B两容器内温度相同,平衡常数只受温度影响,温度相同,则KA=KB,故答案为:$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$;等于;
(2)平衡常数只受温度影响,正反应为放热反应,欲增大该反应K值,只能是降低温度使平衡正向移动,故答案为:B;
(3)设氮气、氢气均为1mol,A中平衡时M(平)=16.7,则混合气体总物质的量为$\frac{1mol×28g/mol+1mol×2g/mol}{16.7g/mol}$≈1.8mol,混合气体减小2mol-1.8mol=0.2mol,由方程式中气体差量可知消耗的氮气为0.2mol×$\frac{1}{2}$=0.1mol,则氮气转化率为$\frac{0.1mol}{1mol}$×100%=10%;
B中平衡时氮气转化率为20%,则转化的氮气为0.2mol,由方程式中气体差量可知混合气体减小物质的量为0.2mol×2=0.4mol,故混合气体总物质的量为2mol-0.4mol=1.6mol,平均相对分子质量为$\frac{1×28+1×2}{1.6}$=18.75;
B中转化反应物转化率程度大,说明B中正向进行程度大,则起始时B中压强应大于A中,恒温下,压强与体积成反比,故容器A体积更大,
故答案为:10%;18.75;A;
(4)0.1mol/L的氨水溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,由于Kw=c(H+)×c(OH-)=10-14,联立可得:c(OH-)=10-3mol/L,电离的氨水浓度为10-3mol/L,则溶液中NH3•H2O的电离度为$\frac{1{0}^{-3}}{0.1}$×100%=1%,联立可得溶液中c(H+)=10-11mol/L,则水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,碱性减弱,溶液中氢离子浓度增大,氢氧根离子浓度减小,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$值增大,
故答案为:1;10-11mol/L;增大;
(5)由电离常数可知,酸性:CH3COOH>H2CO3>HCN>HCO3-,酸性越弱对应盐的水解程度越大,溶液pH越大,则NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值:Na2CO3>NaCN>NaHCO3>CH3COONa,即b>a>c>d,NaCN溶液中通入少量CO2气体生成HCN与NaHCO3,反应离子方程式为:CN-+CO2+H2O=HCN+HCO3-,
故答案为:b>a>c>d;CN-+CO2+H2O=HCN+HCO3-.
点评 本题考查化学平衡计算、平衡常数、弱电解质电离、电离平衡常数等,(5)中关键是根据电离平衡常数判断酸性强弱,难度中等.


实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(1)实验室制备氯气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑.装置A.B间导管短且粗的原因是防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管;验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管.
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(4)装置D中的Na2SO3的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2SO3已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl.H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸;硅被氧化得不到高纯硅.
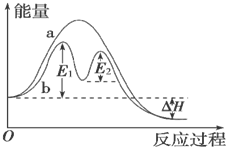
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
 .
. HCO3-+OH-(用离子方程式表示).
HCO3-+OH-(用离子方程式表示).