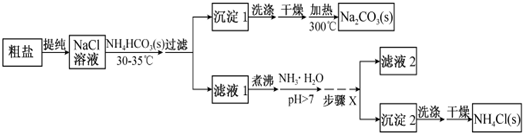
题目内容
3.按要求填空:(1)X、Y、Z为三种气体,把amolX和bmolY充入一密闭容器中,发生反应X+2Y?2Z,达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则 Y的转化率是$\frac{2(a+b)}{5}$×100%.
(2)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)═N2O4(g)+Q反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中,可能与实验结果相符的是BD

分析 (1)设平衡时转化的Y为nmol,则:
X(g)+2 Y(g)?2Z(g)
起始量(mol):a b 0
变化量(mol):0.5n n n
平衡量(mol):a-0.5n b-n n
所以a-0.5n+b-n=n,解得n=$\frac{2(a+b)}{5}$,进而计算Y的转化率;
(2)在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间.那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动.若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高;若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在图D中转折点为平衡状态,转折点左侧为未平衡状态,右侧为平衡状态.
解答 解:(1)设平衡时转化的Y为nmol,则:
X(g)+2 Y(g)?2Z(g)
起始量(mol):a b 0
变化量(mol):0.5n n n
平衡量(mol):a-0.5n b-n n
所以a-0.5n+b-n=n,解得n=$\frac{2(a+b)}{5}$,则Y的转化率为$\frac{\frac{2(a+b)}{5}mol}{bmol}$×100%=$\frac{2(a+b)}{5}$×100%,
故答案为:$\frac{2(a+b)}{5}$×100%;
(2)A.因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故A错误;
B.因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故B正确;
C.若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故C错误;
D.在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,故D正确.
故选:BD.
点评 本题考查化学平衡计算、平衡图象等,题目难度中等,注意分析温度对平衡移动的影响.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案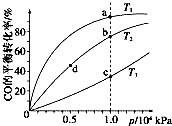 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不
同温度下的平衡转化率与压强的关系如右图所示.
下列说法正确的是 (填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)

已知:某些氢氧化物沉淀的pH如表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成图2防腐示意图,并作相应标注
 和
和 .
. | A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1=△H2+△H3 | D. | △H1+△H2>△H3 |