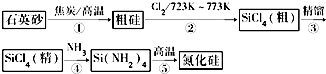
12. (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
①反应 CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
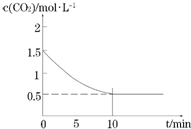
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
11.某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5s的平均速率v(A)=0.17mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(A)=0.41mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% | |
| D. | 相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,反应达到平衡前v(正)<v(逆) |
9.在一个2L的恒容密闭容器中发生反应:A(s)+4B(g)═C(g)+3D(g),10min末,B的物质的量减少2mol,下列有关该反应的表述中正确的是( )
| A. | 0-10min内,用A表示的平均反应速率是0.05mol•L-1•min-1 | |
| B. | 0-10min内,用B表示的平均反应速率是0.01mol•L-1•min-1 | |
| C. | 分别用B、C、D表示反应的速率,其比值是4:3:1 | |
| D. | 随着反应的进行,容器内气体压强始终保持不变 |
8.一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质.SO2(g)+2CO(g)$\stackrel{催化剂}{?}$2X(g)+Y(l)为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
下列说法不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A. | 当v(SO2)正=2v(CO)逆时,该反应达到了平衡状态 | |
| B. | X的化学式为CO2 | |
| C. | 前1s内v(X)=1.00mol•L-1•s-1 | |
| D. | 上述反应达到平衡时,CO的转化率为50% |
5.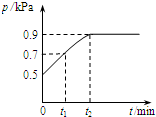 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | t1时n(X)=0.04 mol | |
| B. | t1到t2,混合气体的平均相对分子量增大 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率减少 |
4.某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2 的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列正确的是( )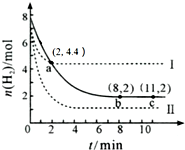

| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |
3.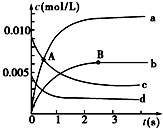 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)A点处,v(正)大于v(逆),A点正反应速率大于B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.
0 172472 172480 172486 172490 172496 172498 172502 172508 172510 172516 172522 172526 172528 172532 172538 172540 172546 172550 172552 172556 172558 172562 172564 172566 172567 172568 172570 172571 172572 172574 172576 172580 172582 172586 172588 172592 172598 172600 172606 172610 172612 172616 172622 172628 172630 172636 172640 172642 172648 172652 172658 172666 203614
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.
 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.