题目内容
10. 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.请回答有关问题.
方法一:以CO2为原料合成甲醇,其反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.58kJ•mol-1
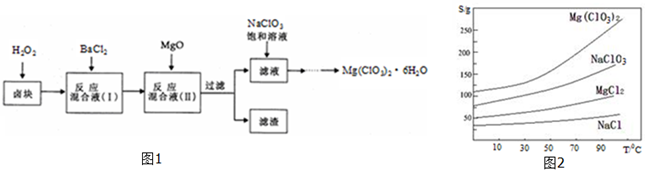
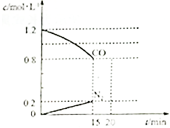
若将6molCO2和8molH2充入一容积为2L的密闭容器中(保持温度不变),测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标).回答下列问题:
(1)该反应在0~8min内CO2的平均反应速率为0.125mol/(L.min)
(2)此温度下该反应的平衡常数K为0.5
(3)仅改变某一条件再实验,测得n(H2)的变化如图虚线所示.如曲线Ⅱ的改变条件可能是BD(填序号)
A.升高温度 B.增大压强C.催化剂 D.充入CO2
方法二:用氨水捕捉烟气中的CO2生成铵盐
(4)写出氨水捕捉烟气中的CO2生成碳酸氢铵的化学方程式NH3+CO2+H2O=NH4HCO3该铵盐溶液中阴离子浓度大小关系为c(HCO3-)>c(OH-)>c(CO32-)(电离常:NH3•H2OK=1.8×10-5 H2CO3 K1=4.4×10-7、K2=4.7×10-11)
(5)在实验过程中可能有中间产物氨基甲酸铵(NH2COONH4)生成,氨基甲酸铵在一定温度下发生分解反应:NH2COONH4(s)?2NH3(g)+CO2(g),若该反应平衡时总压强为3aPa,保持温度不变,将反应容器的体积扩大一倍,达新平衡时,p(NH3)0.2a Pa.
分析 (1)由图可知,8min时△n(H2)=8mol-2mol=6mol,根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比等于化学计量数之比计算v(CO2);
(2)由图中数据可知,8min时反应到达平衡,平衡时氢气物质的量为2mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol):6 8 0 0
变化量(mol):2 6 2 2
平衡量(mol):4 2 2 2
计算各组分平衡浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}({H}_{2})}$计算;
(3)曲线Ⅱ与实线相比,到达平衡时间缩短,反应速率加快,且平衡时氢气的物质的量减小,说明改变条件平衡正向移动;
(4)由题目信息可知:氨气与二氧化碳、水反应生成碳酸氢铵;由电离平衡常数可知,碳酸氢根的水解程度大于电离程度,氢氧根离子源于碳酸氢根水解、水的电离;
(5)保持温度不变,平衡常数不变,平衡常数K=c2(NH3).c(CO2),而平衡体系中氨气与二氧化碳物质的量之比为2:1,平衡时二者浓度也是2:1,则将反应容器的体积扩大一倍,达新平衡时相同物质的浓度不变,故总压强不变,压强之比等于物质的量之比.
解答 解:(1)由图可知,8min时△n(H2)=8mol-2mol=6mol,v(H2)=$\frac{\frac{6mol}{2L}}{8min}$=0.375mol/(L.min),速率之比等于化学计量数之比,则v(CO2)=$\frac{1}{3}$v(H2)=0.125mol/(L.min),
故答案为:0.125mol/(L.min);
(2)由图中数据可知,8min时反应到达平衡,平衡时氢气物质的量为2mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol):6 8 0 0
变化量(mol):2 6 2 2
平衡量(mol):4 2 2 2
平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}({H}_{2})}$=$\frac{\frac{2}{2}×\frac{2}{2}}{\frac{4}{2}×(\frac{2}{2})^{3}}$=0.5,
故答案为:0.5;
(3)曲线Ⅱ与实线相比,到达平衡时间缩短,反应速率加快,且平衡时氢气的物质的量减小,说明改变条件平衡正向移动;
A.升高温度反应速率加快,正反应为放热反应,平衡逆向移动,平衡时氢气的物质的量增大,故A不符合;
B.增大压强反应速率加快,正反应为气体体积减小的反应,平衡正向移动,平衡时氢气的物质的量减小,故B符合;
C.使用催化剂加快反应速率,不影响平衡移动,故C错误;
D.充入CO2加快反应速率,平衡正向移动,平衡时氢气的物质的量减小,故D符合;
故选:BD;
(4)由题目信息可知:氨气与二氧化碳、水反应生成碳酸氢铵,反应方程式为:NH3+CO2+H2O=NH4HCO3;由电离平衡常数可知,碳酸氢根的水解程度大于电离程度,氢氧根离子源于碳酸氢根水解、水的电离,溶液中阴离子浓度:c(HCO3-)>c(OH-)>c(CO32-),
故答案为:NH3+CO2+H2O=NH4HCO3;c(HCO3-)>c(OH-)>c(CO32-);
(5)保持温度不变,平衡常数不变,平衡常数K=c2(NH3).c(CO2),而平衡体系中氨气与二氧化碳物质的量之比为2:1,平衡时二者浓度也是2:1,则将反应容器的体积扩大一倍,达新平衡时相同物质的浓度不变,故总压强不变,压强之比等于物质的量之比,故平衡时p(NH3)=0.3a Pa×$\frac{2}{3}$=0.2a Pa,
故答案为:0.2a Pa.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数等,(5)中利用压强平衡常数更容易理解,难度中等.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
| A. | 制备碱式硫酸铁利用了过氧化氢的氧化性 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质 |
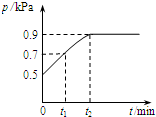 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | t1时n(X)=0.04 mol | |
| B. | t1到t2,混合气体的平均相对分子量增大 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率减少 |
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
| A. | 0.2mol•L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL2mol•L-1NaCl溶液和100mL0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol•L-1 | |
| D. | 10g98%的硫酸(密度为1.84g•cm-3)与10mL18.4mol•L-1的硫酸的浓度是相同的 |


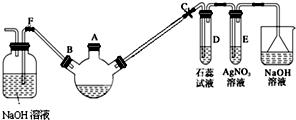 某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题:
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题: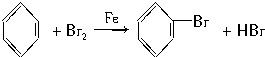 .
. 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: