题目内容
9.在一个2L的恒容密闭容器中发生反应:A(s)+4B(g)═C(g)+3D(g),10min末,B的物质的量减少2mol,下列有关该反应的表述中正确的是( )| A. | 0-10min内,用A表示的平均反应速率是0.05mol•L-1•min-1 | |
| B. | 0-10min内,用B表示的平均反应速率是0.01mol•L-1•min-1 | |
| C. | 分别用B、C、D表示反应的速率,其比值是4:3:1 | |
| D. | 随着反应的进行,容器内气体压强始终保持不变 |
分析 A.物质A为固体,不能用浓度变化量表示该反应速率;
B.根据v=$\frac{△c}{△t}$计算v(B);
C.反应速率之比等于其化学计量数之比;
D.反应前后气体的物质的量不变,恒温恒容下压强不变.
解答 解:A.物质A为固体,不能用浓度变化量表示该反应速率,故A错误;
B.10min末,B的物质的量减少2mol,则v(B)=$\frac{\frac{2mol}{2L}}{10min}$=0.1mol•L-1•min-1,故B错误;
C.反应速率之比等于其化学计量数之比,则v(B):v(C):v(D)=4:1:3,故C错误;
D.反应前后气体的物质的量不变,恒温恒容下,随着反应的进行,容器内气体压强始终保持不变,故D正确,
故选:D.
点评 本题考查化学平衡计算与反应速率计算,难度不大,注意A为固体,不能用浓度变化量表示反应速率.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
11.下列说法错误的是( )
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
20.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.实验室利用反应TiO2(s)+2CCl4(g)→TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下: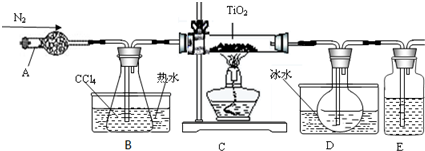
有关性质如下表
(1)仪器A的名称是干燥管,装置E中的试剂是浓硫酸.
(2)反应结束前依次进行如下操作:①停止通氮气 ②熄灭酒精灯 ③冷却至室温.正确的顺序为②③①(填序号).
(3)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(4)使用冰水混合物的目的是冷却TiCl4气体.
(5)TiCl4 遇到湿空气发生强烈的水解,其中一种物质是H2TiO3,试写出该水解反应方程式TiCl4+3H2O═H2TiO3↓+4HCl.
(6)实验室用含量为97%的TiO210克,用上述方法制备TiCl4,最终得到19.8克的产品,则TiO2的转化率为85.95%.

有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)反应结束前依次进行如下操作:①停止通氮气 ②熄灭酒精灯 ③冷却至室温.正确的顺序为②③①(填序号).
(3)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(4)使用冰水混合物的目的是冷却TiCl4气体.
(5)TiCl4 遇到湿空气发生强烈的水解,其中一种物质是H2TiO3,试写出该水解反应方程式TiCl4+3H2O═H2TiO3↓+4HCl.
(6)实验室用含量为97%的TiO210克,用上述方法制备TiCl4,最终得到19.8克的产品,则TiO2的转化率为85.95%.
17.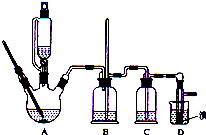 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2O,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如表:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2+H2O,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
4.某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2 的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列正确的是( )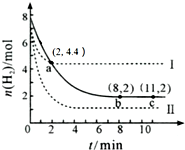

| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |
14.在一定的温度下,1L的密闭容器中通入H2和I2各0.016mol,发生如下反应:H2(g)+I2(g)?2HI(g).一段时间后达到平衡,测得数据如下:
请回答:
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
1.在一定体积的密闭容器中,发生如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
Ⅰ.该反应的平衡常数表达式为:K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
Ⅱ.该反应为吸热(填“吸热”或“放热”)反应.
Ⅲ.某温度下,反应体系中各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的反应温度为700℃.
Ⅳ.830℃时,向该容器中加入1molCO2与1molH2开始反应,达到平衡时,混合气体中CO2的体积分数是25%.
Ⅴ.保持温度不变,若往IV的平衡体系中再通入2molCO2与2molH2,则再达新平衡时,H2的转化率为50%.
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
Ⅱ.该反应为吸热(填“吸热”或“放热”)反应.
Ⅲ.某温度下,反应体系中各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的反应温度为700℃.
Ⅳ.830℃时,向该容器中加入1molCO2与1molH2开始反应,达到平衡时,混合气体中CO2的体积分数是25%.
Ⅴ.保持温度不变,若往IV的平衡体系中再通入2molCO2与2molH2,则再达新平衡时,H2的转化率为50%.
18.科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,生成可进入大气循环的气体,从而实现预期目的.下列判断错误的是( )
| A. | 处理过程中,PH减小 | B. | 废水处理中,亚硝酸盐被还原 | ||
| C. | 废水处理时铝单质转化为AlO2- | D. | 铝粉颗粒大小影响废水处理的速率 |
19.下列有关说法正确的是( )
| A. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| B. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 金属氧化物一定是碱性氧化物 |