题目内容
3.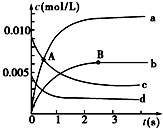 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3.0×10-3mol•L-1•s-1.
(3)能说明该反应已经达到平衡状态的是ad.
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体c.增大O2的浓度 d.选择高效的催化剂.
分析 (1)A点后c浓度继续减小,a的浓度继续增大,故A点向正反应进行,正反应速率继续减小、逆反应速率继续增大到平衡状态b点时正、逆速率相等;
由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡;
(2)氧气是反应物,随反应进行浓度减小,由方程式可知2△c(O2)=△c(NO);
根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);
(3)可逆反应达到平衡时,v正=v逆 (同种物质表示)或正、逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)升高温度、使用催化剂、增大反应物浓度都可能加快反应速率,减低浓度反应速率会减慢.
解答 解:(1)A点后c浓度继续减小,a的浓度继续增大,故A点向正反应进行,则v(正)>v(逆),而b点处于平衡状态,A点正反应速率继续减小、逆反应速率继续增大到平衡状态b点,A点正反应速率>B点正反应速率,
故答案为:大于;大于;
(2)氧气是反应物,随反应进行浓度减小,由方程式可知2△c(O2)=△c(NO),由图可知曲线c的浓度变化为曲线d的2倍,故曲线c表示NO,曲线d表示氧气;
2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{(0.02-0.008)mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(NO2)=v(NO)=3.0×10-3mol•L-1•s-1,
故答案为:d;3.0×10-3mol•L-1•s-1;
(3)a.随反应进行,反应混合气体总的物质的量在减小,恒温恒容下容器内压强减小,容器内压强不再变化说明反应到达平衡,故a正确;
b.若表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故b错误;
c.混合气体的总质量不变,容器容积不变,所以密度自始至终不变,不能说明达到平衡,故c错误;
d.由方程式可知v正(NO2)=2v正(O2),而v逆(NO2)=2v正(O2),故v逆(NO2)=v正(NO2),反应到达平衡,故d正确,
故选:ad;
(4)a.适当升高温度反应速率加快,故a正确;
b.及时分离出NO2气体,反应速率减慢,故b错误;
c.增大O2的浓度,反应速率加快,故c正确;
d.选择高效的催化剂,加快反应速率,故d正确,
故选:acd.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、反应速率计算与影响因素等,难度中等,注意判断平衡的物理量随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | 纯水几乎不导电,因此水是非电解质 | |
| B. | 在任何温度下,纯水的pH均等于7 | |
| C. | 向水中加入钠,溶液中$\frac{{K}_{w}}{c(O{H}^{-})}$减小 | |
| D. | 向水中加入醋酸,c(H+)和水的电离均增大 |

查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(2)操作Ⅳ的顺序依次为蒸发浓缩、冷却结晶、过滤、洗涤.
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A. | 当v(SO2)正=2v(CO)逆时,该反应达到了平衡状态 | |
| B. | X的化学式为CO2 | |
| C. | 前1s内v(X)=1.00mol•L-1•s-1 | |
| D. | 上述反应达到平衡时,CO的转化率为50% |
| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
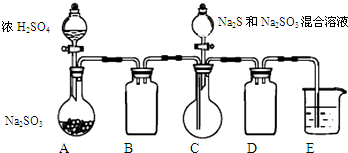 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (b)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (c)
ii.BaS2O3易溶于水.
(1)E中的试剂是NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是溶液变澄清(或浑浊消失).
(4)产品中常含有Na2SO3和Na2SO4.该小组设计了以下实验方案进行检验.
| 步骤 | 实验操作 | 实验现象 |
| I | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
| II | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入 足量稀盐酸 | 沉淀未完全溶解,并有刺激性气味的气体产生 |
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤II设计过滤操作的目的是(用化学方程式和简要文字表述)分离沉淀,防止溶液中的S2O32-遇酸发生反应:S2O32-+2H+=S↓+SO2↑+H2O,干扰实验观察.
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)Na2S2O3常用作脱氯剂.Na2S2O3溶液与Cl2反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
| A. | 5.6克铁反应转移的电子数一定为3NA | |
| B. | 1mol Cl2反应转移的电子数一定是2NA | |
| C. | 标准状况下,22.4L SO3含有的氧原子数目为3NA | |
| D. | 1mol碳正离子CH5+所含的电子总数为10NA |
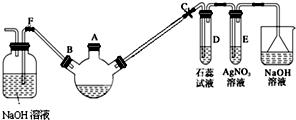 某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题:
某化学课外兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯.请分析后回答下列问题: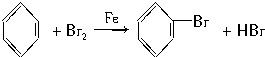 .
.