题目内容
7.氮化硅可用作高温陶瓷复合材料,在航天航空、汽车发动机、机械等领域有着广泛的用途.由石英砂合成氮化硅粉末的路线图如图所示.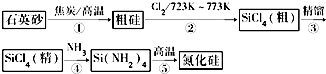
其中-NH2基团中各元素的化合价与NH3相同.请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学反应方程式表示其原因:SiO2+2NaOH═Na2SiO3+H2O.
(2)图示①~⑤的变化中,属于氧化还原反应的是①②.
(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂.SiCl4水解的化学反应方程式为SiCl4+3H2O═4HCl↑+H2SiO3↓.
(4)在反应⑤中,3mol Si(NH2)4在高温下加热可得1mol氮化硅粉末和8mol A气体,则氮化硅的化学式为Si3N4.
(5)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A.写出SiCl4与B和C两种气体反应的化学方程式:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
分析 根据题中反应流程可知,石英砂在高温下被碳还原得到粗硅,粗硅与氯气反应生成粗四氯化硅,精馏后得到较纯的四氯化硅,四氯化硅在高温下与氨反应生成四氨基硅,四氨基硅高温下生成氮化硅,
(1)石英砂主要成分是二氧化硅,二氧化硅与强碱反应生成可溶性硅酸盐;
(2)氧化还原反应必须有化合价的变化,据此判断;
(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,说明有氯化氢产生,根据元素守恒可写出反应方程式;
(4)依据原子个数守恒判断氮化硅的化学式;
(5)根据质量守恒可知四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成.’
解答 解:根据题中反应流程可知,石英砂在高温下被碳还原得到粗硅,粗硅与氯气反应生成粗四氯化硅,精馏后得到较纯的四氯化硅,四氯化硅在高温下与氨反应生成四氨基硅,四氨基硅高温下生成氮化硅,
(1)石英砂主要成分是二氧化硅,二氧化硅与强碱氢氧化钠溶液反应生成可溶性硅钠和水,反应的化学方程式为:SiO2+2NaOH═Na2SiO3+H2O;
故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(2)①石英砂到粗硅,硅元素化合价降低,属于氧化还原反应,故选;
②粗硅与氯气反应生成四氯化硅,硅元素化合价升高,属于氧化还原反应,故选;
③四氯化硅精馏属于物理变化,故不选;
④四氯化硅与氨气反应,不存在化合价的变化,不是氧化还原反应,故不选;
⑤Si(NH2)4高温生成氮化硅,没有化合价的变化,不是氧化还原反应,故不选;
故选:①②;
(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,说明有氯化氢产生,反应方程式为SiCl4+3H2O═4HCl↑+H2SiO3↓,
故答案为:SiCl4+3H2O═4HCl↑+H2SiO3↓;
(4)3mol Si(NH2)4和在高温下加热可得1mol氮化硅粉末和8mol A气体,依据原子个数守恒可知,氮化硅含有4氮原子和3个硅原子,化学式:Si3N4;
故答案为:Si3N4;
(5)四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,方程式为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
点评 本题主要考查了硅及其化合物知识,熟悉硅及其化合物的化学性质是解题关键,注意氧化还原反应的判断依据:是否有化合价的变化,题目难度不大.

| A. | 容器中含D物质的量至少为0.45 mol | |
| B. | A的平均反应速率是0.010 mol•L-1•s-1 | |
| C. | 容器中A、B、C、D的物质的量之比一定是4:5:4:6 | |
| D. | 容器中A的物质的量一定增加了0.30 mol |
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
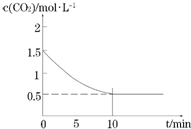
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
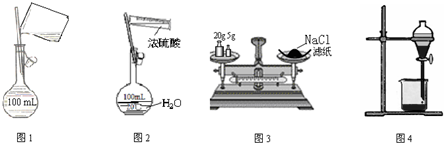
| A. | 图1配制250mL0.10mol•L-1盐酸 | B. | 图2稀释浓硫酸 | ||
| C. | 图3称量氯化钠固体 | D. | 图4CCl4萃取碘水的分液操作 |
 某学习小组为探究部分元素化合物的性质,设计了下面的实验装置:
某学习小组为探究部分元素化合物的性质,设计了下面的实验装置: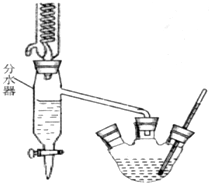 已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:
已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题: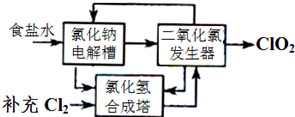 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂. 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程: ,试写出:
,试写出: .
. .
. .
. ,
,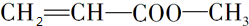 ,
,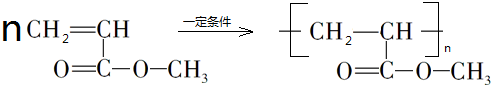 .
.