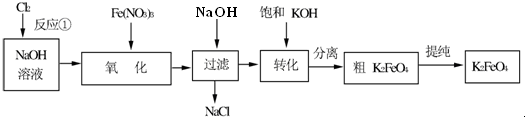
题目内容
12. (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
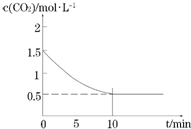
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
分析 (1)①已知:Ⅰ.Fe(s)+CO2(g)?FeO(s)+CO(g)
Ⅱ.Fe(s)+H2O(g)?FeO(s)+H2(g)
由盖斯定律,Ⅰ-Ⅱ可得:CO2(g)+H2(g)?CO(g)+H2O(g),焓变也等于二者之差,平衡常数为二者的商;
分别计算700℃、900℃平衡常数,根据温度对平衡常数的影响判断反应是吸热反应,还是放热反应;
②A.反应气体气体物质的量不变,恒温恒容下,容器中压强始终不变;
B.平衡时反应混合物各组分的浓度保持不变;
C.容器中密度始终保持不变;
D.CO、CO2的平衡浓度与二氧化碳的转化率有关;
(2)由图可知,10min到达平衡,平衡时CO2的浓度为0.5mol/L,则:
Fe(s)+CO2(g)?FeO(s)+CO(g)
起始量(mol/L):1.5 0
变化量(mol/L):1 1
平衡量(mol/L):0.5 0.5
①平衡常数K=$\frac{c(CO)}{c(C{O}_{2})}$,根据v=$\frac{△c}{△t}$计算v(CO);
若铁粉足量,CO2的起始浓度为2.0mol•L-1,等效再原平衡的基础上压强增大,反应前后气体的体积不变,与原平衡相比,平衡不移动,二氧化碳的转化率相同;
②平衡常数K=$\frac{c(CO)}{c(C{O}_{2})}$,只受温度影响,由表中数据可知,随温度升高平衡常数增大.
解答 解:(1)①已知:Ⅰ.Fe(s)+CO2(g)?FeO(s)+CO(g)
Ⅱ.Fe(s)+H2O(g)?FeO(s)+H2(g)
由盖斯定律,Ⅰ-Ⅱ可得:CO2(g)+H2(g)?CO(g)+H2O(g),则△H=△H1-△H2,平衡常数K=$\frac{{K}_{1}}{{K}_{2}}$,
700℃平衡常数为$\frac{1.47}{2.38}$,900℃平衡常数为$\frac{2.15}{1.67}$,可知升高温度平衡常数增大,说明正反应为吸热反应,
故答案为:△H1-△H2;$\frac{{K}_{1}}{{K}_{2}}$;吸热;
②A.反应气体气体物质的量不变,恒温恒容下,容器中压强始终不变,故A错误;
B.混合气体中c(CO)不变说明反应到达平衡,故B正确;
C.混合气体总质量不变,容器容积不变,容器中密度始终保持不变,故C错误;
D.CO、CO2的平衡浓度与二氧化碳的转化率有关,平衡时二氧化碳转化率不一定为50%,故D错误,
故选:B;
(2)由图可知,10min到达平衡,平衡时CO2的浓度为0.5mol/L,则:
Fe(s)+CO2(g)?FeO(s)+CO(g)
起始量(mol/L):1.5 0
变化量(mol/L):1 1
平衡量(mol/L):0.5 1
①平衡常数K=$\frac{c(CO)}{c(C{O}_{2})}$=$\frac{1}{0.5}$=2,v(CO)=$\frac{1mol/L}{10min}$=0.1mol/(L.min);
若铁粉足量,CO2的起始浓度为2.0mol•L-1,等效再原平衡的基础上压强增大,反应前后气体的体积不变,与原平衡相比,平衡不移动,二氧化碳的转化率相同,则平衡时则平衡时CO2的浓度为0.5mol/L×$\frac{2}{1.5}$=0.67mol/L,
故答案为:2;0.1;0.67;
②平衡时$\frac{c(CO)}{c(C{O}_{2})}$值表示平衡常数,
A.由表中数据可知,随温度升高平衡常数增大,故A正确;
B.增大压强不影响平衡移动,温度不变,平衡常数不变,故B错误;
C.充入一定量的CO2,平衡虽然正向移动,但温度不变,平衡常数不变,故C错误;
D.再加入一定量铁粉,平衡不移动,温度不变,平衡常数不变,故D错误,
故选:A.
点评 本题考查化学平衡计算、平衡状态判断、平衡常数计算与应用等,侧重考查学生分析计算能力,难度中等.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.20mol/L | |
| D. | 反应至6min时,H2O2分解了40% |
| A. | 1molCl2与足量 Fe 反应,转移的电子数为 3NA | |
| B. | 在常温常压下,1.7g NH3含有的原子数为 0.4NA | |
| C. | 标准状况下,11.2 L 水中含有的原子数是 1.5NA | |
| D. | 0.2 mol?L-1 的 Na2SO4溶液中含 Na+数目为 0.4NA |
 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下: