题目内容
5.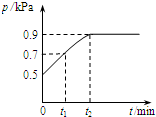 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | t1时n(X)=0.04 mol | |
| B. | t1到t2,混合气体的平均相对分子量增大 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率减少 |
分析 A.利用压强之比等于物质的量之比计算t1时混合气体总物质的量,由方程式可知混合气体物质的量减少量等于参加反应X的物质的量;
B.t1到t2反应继续向正反应进行,混合气体总物质的量增大,而混合气体总质量不变;
C.升高温度平衡逆向移动,Y的含量降低;
D.其他条件不变,再充入0.1 mol 气体X,等效为在原平衡的基础上压强增大一倍,与原平衡相比逆向移动.
解答 解:A.由于恒温恒容下,压强之比等于物质的量之比,则t1时混合气体总物质的量为0.1mol×$\frac{0.7}{0.5}$=0.12mol,由方程式可知混合气体物质的量减少量等于参加反应X的物质的量,故转化的X为(0.12mol-0.1mol)=0.02mol,t1时n(X)=0.1mol-0.02mol=0.08 mol,故A错误;
B.t1到t2反应继续向正反应进行,混合气体总物质的量增大,而混合气体总质量不变,由M=$\frac{m}{n}$可知,t1到t2混合气体的平均相对分子量减小,故B错误;
C.减少Z的量,平衡正向移动,可以增大Y的含量,但正反应为放热反应,升高温度平衡逆向移动,Y的含量降低,故C错误
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,所到达的平衡等效为在原平衡的基础上压强增大一倍,与原平衡相比逆向移动,X的转化率减小,故D正确,
故选:D.
点评 本题考查化学平衡计算与影响因素,侧重考查学生分析计算能力,D选项注意利用等效思想解答,难度中等.

练习册系列答案
相关题目
13.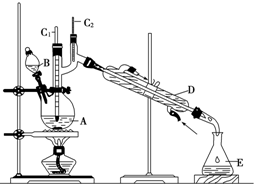 正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.
发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中,在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(2)上述装置图中,D仪器的名称是直形冷凝管.
(3)将正丁醛粗产品置于分液漏斗中分水时,水在下(填“上”或“下”)层.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定.
 正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如右装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中,在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(2)上述装置图中,D仪器的名称是直形冷凝管.
(3)将正丁醛粗产品置于分液漏斗中分水时,水在下(填“上”或“下”)层.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定.
17.工业上消除氮氧化物的污染可用如下反应:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如表.下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
15.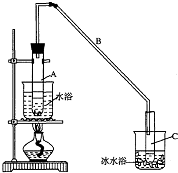 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: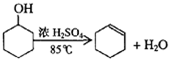
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,
缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静 置、分层,环己烯在上层,分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②实验制得的环己烯精品的质量往往低于理论产量,其可能的原因是c
a.蒸馏时从100℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,
缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静 置、分层,环己烯在上层,分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②实验制得的环己烯精品的质量往往低于理论产量,其可能的原因是c
a.蒸馏时从100℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.
高效利用CO2是“低碳经济”的有效途径,现有以下两种利用CO2的方法.