1.鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.实验测得角鲨烯分子是链状结构,分子中含有30个碳原子且碳、氢元素质量比为7.2:1,下列说法中不正确的是( )
| A. | 角鲨烯分子式为C30H50 | |
| B. | 角鲨烯与分子式为C29H48的物质可能属于同系物 | |
| C. | 角鲨烯完全加氢后为C30H62 | |
| D. | 1mol角鲨烯最多可与5mol溴单质加成 |
20.在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).满足该条件的反应可能是( )
| A. | pH=2的CH3COOH与pH=12的NaOH溶液等体积混合 | |
| B. | 0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合 | |
| C. | CH3COOH与NaOH溶液混合后所得溶液的pH=7 | |
| D. | 0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
19.能正确表示下列反应的离子方程式是( )
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| B. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
18.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,导致测得NaOH溶液浓度偏高的是( )
| A. | 取用NaOH待测液前用少量水洗涤锥形瓶 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 摇动锥形瓶时有少量待测液溅出瓶外 | |
| D. | 滴定前滴定管中有气泡,滴定后消失 |
17.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=12溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
14.自然界中,锰的主要矿石有软锰矿(主要成分Mn02)和菱锰矿(主要成分MnCO3 )金属锰的提炼方式主要有火法和湿法两种.请回答下列问题:
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
湿法炼锰有电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化、沉淀除杂及产品回收.其生产工艺流程如图:
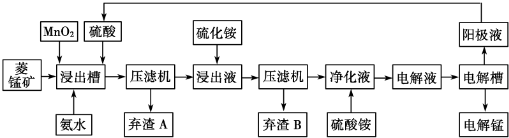
已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+
②生成氢氧化物的pH如下表:
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-1gKsp)
(2)菱锰矿粉与硫酸反应的化学方程式是MnCO3+H2SO4═MnSO4+H2O+CO2↑
(3)Mn02的作用是除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是MnO2+2 Fe2++4H+═2 Fe3++Mn2++2H2O
(4)使用氨水的目的是调整pH到2.7-7.6之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入硫化按的目的是作沉淀剂,生成NiS、CoS沉淀
(5)电解槽中使用的是惰性电极板,电解反应方程式为2MnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+O2↑+2Mn.
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
湿法炼锰有电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化、沉淀除杂及产品回收.其生产工艺流程如图:

已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+
②生成氢氧化物的pH如下表:
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(3)Mn02的作用是除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是MnO2+2 Fe2++4H+═2 Fe3++Mn2++2H2O
(4)使用氨水的目的是调整pH到2.7-7.6之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入硫化按的目的是作沉淀剂,生成NiS、CoS沉淀
(5)电解槽中使用的是惰性电极板,电解反应方程式为2MnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+O2↑+2Mn.
12.如图为中学化学实验中的常见实验装置
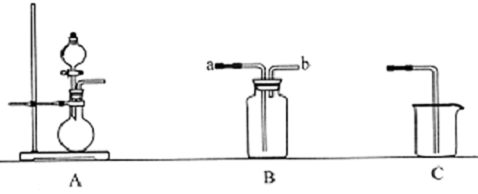
(1)装置A可用于制备多种气体.请写出用A装置制备下列气体时.圆底烧瓶和分液漏斗中应装入的化学试剂.
(2)装置B收集多种气体,若要用于收集氨气.则进气管为b(填字母):
若要收集NO,简述用装置B收集NO的方法将B瓶中装满水,塞上橡皮塞,从b口通入NO气体,将水从a口排出.
(3)现要用上述装置制取Cl2设计实验比较氯元素和硫元索的非金属性的强弱.请在表格内依次填上所需的装置和所发生的离子反应方程式(可不填满).
0 169957 169965 169971 169975 169981 169983 169987 169993 169995 170001 170007 170011 170013 170017 170023 170025 170031 170035 170037 170041 170043 170047 170049 170051 170052 170053 170055 170056 170057 170059 170061 170065 170067 170071 170073 170077 170083 170085 170091 170095 170097 170101 170107 170113 170115 170121 170125 170127 170133 170137 170143 170151 203614

(1)装置A可用于制备多种气体.请写出用A装置制备下列气体时.圆底烧瓶和分液漏斗中应装入的化学试剂.
| 气体 | O2 | CO2 | NH3 |
| 试剂 |
若要收集NO,简述用装置B收集NO的方法将B瓶中装满水,塞上橡皮塞,从b口通入NO气体,将水从a口排出.
(3)现要用上述装置制取Cl2设计实验比较氯元素和硫元索的非金属性的强弱.请在表格内依次填上所需的装置和所发生的离子反应方程式(可不填满).
| 装置 | 离子方程式 |
