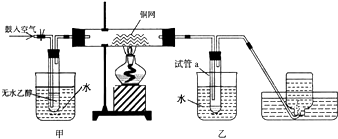
题目内容
19.能正确表示下列反应的离子方程式是( )| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| B. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
分析 A.乙酸乙酯与氢氧化钠溶液反应生成乙酸钠和乙醇;
B.Ag(NH3)2OH应写成离子的形式;
C.向苯酚钠溶液中通入少量的CO2生成碳酸氢钠和苯酚;
D.甘氨酸含有羧基,可与氢氧化钠发生中和反应.
解答 解:A.乙酸乙酯与氢氧化钠溶液反应生成乙酸钠和乙醇,正确的离子方程式为CH3COOC2H5+OH-→CH3COO-+C2H5OH,故A错误;
B.Ag(NH3)2OH应写成离子的形式,应为为CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O,故B错误;
C.苯酚酸性比碳酸氢钠强,比碳酸弱智,则向苯酚钠溶液中通入少量的CO2生成碳酸氢钠和苯酚,反应的离子方程式为CO2+H2O+C6H5O-→C6H5OH+HCO3-,故C错误;
D.甘氨酸含有羧基,可与氢氧化钠发生中和反应,离子方程式为H2N-CH2COOH+OH-→H2N-CH2COO-+H2O,故D正确.
故选D.
点评 本题考查离子反应的书写,为高考高频考点,把握发生的化学反应为解答的关键,注意单质、弱电解质、沉淀等在离子反应中保留化学式,注重基础知识的考查,题目难度不大.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
7.由CO、H2和O2组成的混合气体60mL.在一定条件下恰好完全反应,测得生成物在101kPa,120℃下对氮气的相对密度为1.262,则原混合气体中H2的体积分数约为( )
| A. | $\frac{2}{9}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
14.自然界中,锰的主要矿石有软锰矿(主要成分Mn02)和菱锰矿(主要成分MnCO3 )金属锰的提炼方式主要有火法和湿法两种.请回答下列问题:
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
湿法炼锰有电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化、沉淀除杂及产品回收.其生产工艺流程如图:
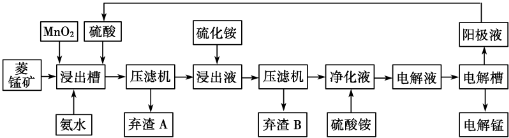
已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+
②生成氢氧化物的pH如下表:
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-1gKsp)
(2)菱锰矿粉与硫酸反应的化学方程式是MnCO3+H2SO4═MnSO4+H2O+CO2↑
(3)Mn02的作用是除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是MnO2+2 Fe2++4H+═2 Fe3++Mn2++2H2O
(4)使用氨水的目的是调整pH到2.7-7.6之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入硫化按的目的是作沉淀剂,生成NiS、CoS沉淀
(5)电解槽中使用的是惰性电极板,电解反应方程式为2MnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+O2↑+2Mn.
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
湿法炼锰有电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化、沉淀除杂及产品回收.其生产工艺流程如图:

已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+
②生成氢氧化物的pH如下表:
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(3)Mn02的作用是除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是MnO2+2 Fe2++4H+═2 Fe3++Mn2++2H2O
(4)使用氨水的目的是调整pH到2.7-7.6之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入硫化按的目的是作沉淀剂,生成NiS、CoS沉淀
(5)电解槽中使用的是惰性电极板,电解反应方程式为2MnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+O2↑+2Mn.
11.实验室中用二氧化锰和浓盐酸制氯气,主要操作有:①用药匙向烧瓶中加二氧化锰,再向分液漏斗中加入浓盐酸,并将导气管放入集气瓶中;②放置酒精灯,根据酒精灯确定铁圈高度,固定铁圈放置石棉网;③将烧瓶固定在铁架台上;④检查装置气密性;⑤装好分液漏斗,连接好导气管.则比较合理的实验操作顺序是( )
| A. | ②①④③⑤ | B. | ②③④①⑤ | C. | ②③⑤④① | D. | ①②③④⑤ |
8.下列实验操作中,正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏时,冷却水从冷凝管的上口通入,下口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配制1.00 mol/L NaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解 |
9.能证明淀粉部分水解成葡萄糖的试剂是( )
| A. | 淀粉-碘化钾溶液和溴水 | B. | 氢氧化钠溶液与碘水 | ||
| C. | 新制Cu(OH)2悬浊液与碘水 | D. | 碘化钾溶液与碘水 |
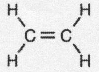 .
.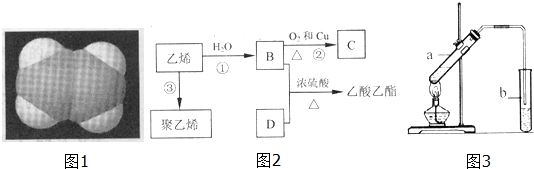
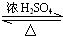 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.