题目内容
15.已知:A.B.C.D为周期表1-36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等:C的基态原子2p能级上的未成对电子数与A原子相同:D的基态原子的M电子层上有4个未成对电子.请回答下列问题:
(1 )D元素在元素周期表中位于d区;其正二价离子的外围电子排布式为3d6
(2)A.B,C三种元素的第一电离能从大到小的顺序为N>O>C(用元素符号表示).
(3)由A,B,C形成的离子CAB一与分子AC2互为等电子体,则CAB一中A原子的杂化方式为sp.B的最简单氢化物的沸点远高于A的最简单氢化物的沸点.其主要原因是NH3分子间存在氢键,而CH4分子间只存在范德华力,氢键作用力远大于范德华力,所以NH3的沸点更高
(4)D与AC易形成配合物D(AC)5,在D(AC)5中D的化合价为0.已知D(AC)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于分子晶体(填晶体类型))
(5)原子体AC2的晶胞可作如下推导:先将NaCl晶胞中的所有C1-去掉,并将Na+全部换成A原子,再在每两个不共面的“小立方体”中心处各放置一个A原子便构成了晶体A的一个晶胞.假设再在每两个距离最近的A原子中心连线的中点处增添一个C原子,便构成了AC2晶胞,则AC2晶胞中有8个A原子,16个C原子,若AC2的晶体的密度为d g.cm-3,则AC原子间的最短距离为$\frac{\sqrt{3}}{8}×\root{3}{\frac{352}{{N}_{A}}}$cm.
分析 A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大,A的基态原子有3个不同的能级,各能级中电子数相等,核外电子排布为1s22s22p2,则A为C元素;C的基态原子2p能级上的未成对电子数与A原子相同,核外电子排布为1s22s22p4,则C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D的基态原子的M电子层上有4个未成对电子,核外电子排布为1s22s22p63s23p63d64s2,则D为Fe,据此解答.
解答 解:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等,核外电子排布为1s22s22p2,则A为碳元素;C的基态原子2p能级上的未成对电子数与A原子相同,核外电子排布为1s22s22p4,则C为O元素;B元素原子序数介于碳、氧之间,则B为N元素;D的基态原子的M电子层上有4个未成对电子,核外电子排布为1s22s22p63s23p63d64s2,则D为Fe.
(1)D为Fe元素,处于第四周期第ⅤⅢ族,属于d区元素,原子核外有26个电子,基态原子的外围电子排布式为3d64s2,其正二价离子的外围电子排布式为3d6,
故答案为:d;3d6;
(2)同周期随原子序数增大,元素第一电离能层增大趋势,但是由于N元素得的2p轨道处于半充满状态,故第一电离能氮大于氧,故第一电离能N>O>C,
故答案为:N>O>C;
(3)离子OCN-与分子CO2互为等电子体,则OCN-中C原子与氧原子、N原子之间分别形成2对共用电子对,C原子的杂化方式为sp;
NH3分子间存在氢键,而CH4分子间只存在范德华力,氢键作用力远大于范德华力,所以NH3的沸点更高,
故答案为:sp;NH3分子间存在氢键,而CH4分子间只存在范德华力,氢键作用力远大于范德华力,所以NH3的沸点更高;
(4)Fe(CO)5中Fe元素化合价为0价,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于分子晶体,
故答案为:0;分子晶体;
(5)NaCl晶胞如图: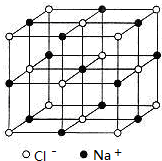 ,则黑球可以看成是C原子,“小立方体”中可放置四个C原子,故CO2晶胞中有4+1+12×$\frac{1}{4}$=8个C原子,故含有O原子数目为8×2=16;
,则黑球可以看成是C原子,“小立方体”中可放置四个C原子,故CO2晶胞中有4+1+12×$\frac{1}{4}$=8个C原子,故含有O原子数目为8×2=16;
设“小立方体”的边长为a,中心C原子与小立方体中心C原子的距离为$\frac{\sqrt{3}}{2}$a<$\sqrt{2}$a,故最近的两个C原子的距离是$\frac{\sqrt{3}}{2}$a,晶胞质量为8×$\frac{44}{{N}_{A}}$g,若CO2的晶体的密度为d g.cm-3,则晶胞体积为8×$\frac{44}{{N}_{A}}$g÷d g.cm-3=$\frac{352}{{N}_{A}}$cm3,则AC原子间的最短距离为$\root{3}{\frac{352}{{N}_{A}}}$cm×$\frac{1}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{2}$=$\frac{\sqrt{3}}{8}×\root{3}{\frac{352}{{N}_{A}}}$cm,
故答案为:8;16;$\frac{\sqrt{3}}{8}×\root{3}{\frac{352}{{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化方式、氢键、晶体类型的判断、晶胞计算等,(5)为易错点、难点,需要学生具备一定的空间想象与数学计算能力,熟练识记中学常见晶胞结构.

| A. | 电解饱和食盐水制备金属钠 | B. | 加热分解Ag2O制备金属银 | ||
| C. | Fe2O3与CO高温下反应制备金属铁 | D. | Cu2S与O2高温下反应制备金属铜 |
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 硝酸溶液和烧碱溶液反应 | ||
| C. | 醋酸和KOH溶液反应 | D. | 盐酸和氢氧化铁反应 |
①混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=9.9×10-7mol/L.
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH<7.(填“>7”、“<7”、或“无法确定”)
(4)(Ⅰ)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下表所示.
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00[来 |
②下列情况可能引起测定结果偏高的是AD.
A、酸式滴定管未用标准盐酸溶液润洗
B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定前,滴定管中的溶液液面最低点在“0”点以下
(Ⅱ)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KBr B.KI C.K2S D.K2CrO4.
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A. | c(HC03-)>c(C10- )>c(OH-) | |
| B. | c(Na+)=c(C1O-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3 -)+c(H2CO3)+c(CO32-) | |
| D. | (Na+)+c(H+)=c(HCO3-)+c(ClO- )+c(OH-)+2 c(CO32-) |
| A. | pH=2的CH3COOH与pH=12的NaOH溶液等体积混合 | |
| B. | 0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合 | |
| C. | CH3COOH与NaOH溶液混合后所得溶液的pH=7 | |
| D. | 0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
| A. | Q2=2Q1 | B. | Q1<0.5 Q2 | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
| A. | 温室效应--二氧化碳 | B. | 酸雨--二氧化碳 | ||
| C. | 白色污染--废塑料制品 | D. | 臭氧层破坏--氟氯代烷 |
| A. | 乙烯与溴化氢混合 | B. | 将乙烯通入溴的四氯化碳溶液中 | ||
| C. | 乙烷与溴蒸气混合 | D. | 将乙炔通入溴的四氯化碳溶液中 |