题目内容
12.如图为中学化学实验中的常见实验装置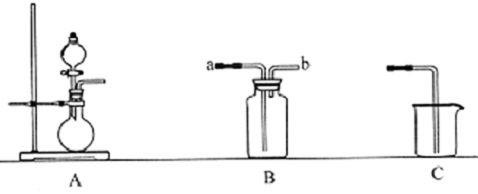
(1)装置A可用于制备多种气体.请写出用A装置制备下列气体时.圆底烧瓶和分液漏斗中应装入的化学试剂.
| 气体 | O2 | CO2 | NH3 |
| 试剂 |
若要收集NO,简述用装置B收集NO的方法将B瓶中装满水,塞上橡皮塞,从b口通入NO气体,将水从a口排出.
(3)现要用上述装置制取Cl2设计实验比较氯元素和硫元索的非金属性的强弱.请在表格内依次填上所需的装置和所发生的离子反应方程式(可不填满).
| 装置 | 离子方程式 |
分析 (1)装置A为固体与液体不需要加热的反应,据此解答即可;
(2)B装置排液收集气体,则短管进气,长管出水;
(3)高锰酸钾在常温下可以与盐酸反应生成氯气,氯气能置换出硫化钠中的S,氯气有毒,需要尾气处理,据此解答即可.
解答 解:(1)装置A中反应的特点为固体与液体不需要加热的反应,制备氧气可以用双氧水与二氧化锰,或过氧化钠与水反应;碳酸钙与稀盐酸反应可以制取二氧化碳气体;浓氨水中加入氧化钙,氧化钙遇到水会放热,同时生成强碱,促进氨气挥发,故答案为:
| MnO2和H2O2溶液 或Na2O2和H2O | CaCO3和稀盐酸 | CaO和浓氨水 |
(3)高锰酸钾在常温下可以与盐酸反应生成氯气,故选取A为制取氯气装置,氯气能置换出硫化钠中的S,故采用装置B为验证装置,由于氯气有毒,不能直接排放入大气,故采用氢氧化钠溶液吸收多余的氯气,离子反应方程式分别为:2MnO4-+8H++10Cl-═2Mn2++5Cl2↑+4H2O、S2-+Cl2═2Cl-+S↓、Cl2+2OH-═Cl-+ClO-+H2O,故答案为:
| A | 2MnO4-+8H++10Cl-═2Mn2++5Cl2↑+4H2O |
| B | S2-+Cl2═2Cl-+S↓ |
| B或C | Cl2+2OH-═Cl-+ClO-+H2O |
点评 本题主要考查的是常见气体的制取方法与设计实验验证非金属强弱,涉及离子反应方程式书写等,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 金属元素和非金属元素分界线附近的元素 | |
| B. | 右上方区域的非金属元素 | |
| C. | 过渡元素 | |
| D. | 稀有气体元素 |
3.下列电离方程式中,正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | NH3•H2O═NH4++OH- |
20.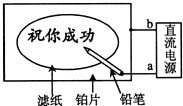 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生还原反应 | B. | 铂片端作阳极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
7.由CO、H2和O2组成的混合气体60mL.在一定条件下恰好完全反应,测得生成物在101kPa,120℃下对氮气的相对密度为1.262,则原混合气体中H2的体积分数约为( )
| A. | $\frac{2}{9}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
17.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=12溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
1.含硅元素的物质有很多用途,下列说法不正确的是( )
| A. | 水玻璃是硅酸钠的水溶液,可用作木材防火剂的原料 | |
| B. | 化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是SiO2 | |
| C. | 我国的三峡大坝使用了大量水泥,水泥是硅酸盐材料 | |
| D. | 光导纤维主要成份为SiO2,可用作太阳能电池 |
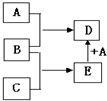 已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略). ,A和E在一定条件下反应生成D的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO.
,A和E在一定条件下反应生成D的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO.