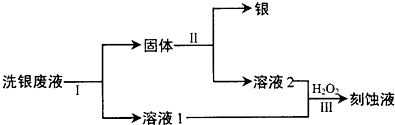
题目内容
18.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,导致测得NaOH溶液浓度偏高的是( )| A. | 取用NaOH待测液前用少量水洗涤锥形瓶 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 摇动锥形瓶时有少量待测液溅出瓶外 | |
| D. | 滴定前滴定管中有气泡,滴定后消失 |
分析 A.用蒸馏水洗涤锥形瓶后,水对待测液的物质的量不影响;
B.滴定管没有润洗,导致待测液浓度减小,测定结果偏低;
C.待测液减少,消耗的标准液体积减小,测定结果偏低;
D.滴定前有气泡,滴定后消失,则导致消耗的标准液体积偏大,测定结果偏高.
解答 解:A.取用NaOH待测液前用少量水洗涤锥形瓶,该操作方法合理,不影响测定结果,故A错误;
B.碱式滴定管量取NaOH溶液时,未进行润洗操作,导致强氧化钠溶液被吸收,滴定过程中消耗的标准液体积偏小,测定结果偏低,故B错误;
C.摇动锥形瓶时有少量待测液溅出瓶外,则待测液中强氧化钠的物质的量减小,消耗的标准液体积减小,则测定结果偏低,故C错误;
D.滴定前滴定管中有气泡,滴定后消失,计算出的消耗的标准液体积偏大,测定结果偏高,故D正确;
故选D.
点评 本题考查了中和滴定中的误差分析,题目难度中等,注意掌握中和滴定操作方法,明确误差分析的方法与技巧,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,按要求回答下列问题.
(1)元素①~⑨中,金属性最强的元素是Na(填元素符号).
(2)元素③的原子结构示意图是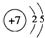 .
.
(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是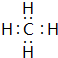 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.
(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3(填化学式).
(5)下列可以判断元素④和⑨非金属性强弱的是bc(填序号).
a.单质的熔点④比⑨低 b.单质与氢气反应④比⑨剧烈
c.气态氢化物稳定性④比⑨强 d.单质的密度④比⑨小
(6)元素⑥的单质和元素⑤的最高价氧化物对应的水化物的溶液反应,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)元素③的原子结构示意图是
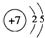 .
.(3)元素①和②可以形成多种化合物,其中是天然气主要成分的化合物的电子式是
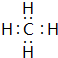 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.(4)元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3(填化学式).
(5)下列可以判断元素④和⑨非金属性强弱的是bc(填序号).
a.单质的熔点④比⑨低 b.单质与氢气反应④比⑨剧烈
c.气态氢化物稳定性④比⑨强 d.单质的密度④比⑨小
(6)元素⑥的单质和元素⑤的最高价氧化物对应的水化物的溶液反应,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
9.实验室欲使1.6g氧化铁完全还原,事先应准备的CO在标准状况下的体积为( )
| A. | 672mL | B. | 336mL | C. | 大于672mL | D. | 小于336mL |
6.下列说法正确的是( )
| A. | SO2通入碘水中,反应的离子方程式为:SO2+I2+H2O═SO32-+2I-+2H+ | |
| B. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、A102- N03 - | |
| C. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
10.下列说法不正确的是( )
| A. | 同种元素的质子数必定相同 | |
| B. | 元素的化学性质主要决定于原子的最外层电子数 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | 元素性质呈现周期性变化的根本原因是核外电子排布呈周期性变化 |
7.垃圾分类有利于资源回收利用.下列垃圾归类不合理的是( )
| A. | 废易拉罐--可回收物 | B. | 废塑料瓶--其他垃圾 | ||
| C. | 废荧光灯管--有害垃圾 | D. | 不可再生废纸--可燃垃圾 |
8.某气态烃1mol能与2molHCl加成,加成后产物分子上的氢原子又可被6molCl2取代,则该气态烃可能是( )
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH2 | D. | CH2=CH-CH=CH2 |