题目内容
20.在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).满足该条件的反应可能是( )| A. | pH=2的CH3COOH与pH=12的NaOH溶液等体积混合 | |
| B. | 0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合 | |
| C. | CH3COOH与NaOH溶液混合后所得溶液的pH=7 | |
| D. | 0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
分析 醋酸为弱酸,不能完全电离,当c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,应为醋酸过量,以此解答该题.
解答 解:A.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合,完全反应生成CH3COONa和醋酸的混合溶液,以醋酸的电离为主溶液呈酸性,离子浓度符合条件,故A正确;
B.0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合,得到等物质的量浓度是氢氧化钠和醋酸钠,溶液呈碱性,所以不符合条件,故B错误;
C.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7,应存在c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故C错误;
D.0.1 mol•L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合,完全反应生成CH3COONa,为强碱弱酸盐,溶液呈碱性,故D错误;
故选A.
点评 本题考查酸碱混合的定性判断以及离子浓度的大小比较,题目难度中等,注意从溶液电中性原则分析,把握弱电解质的电离和盐类水解的特点.

练习册系列答案
相关题目
11.在下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 0.5L0.1mol/L的NaCl溶液 | B. | 1L0.2mol/L的MgCl2溶液 | ||
| C. | 1L0.3mol/L盐酸溶液 | D. | 100mL0.2mol/L的AlCl3溶液 |
8.在反应4HCl+O2═2C12+2H2O中,已知2molO2被还原时,放出akJ的热量,且断开1 mol O2需要吸收b kJ的热量,断开1mol Cl2需要吸收c kJ的热量.则断开1mol H-0键比断开1mol H-Cl键所需能量高( )
| A. | $\frac{a+b-2c}{4}$kJ | B. | $\frac{a+2b-4c}{8}$kJ | C. | $\frac{b-a-2c}{4}$kJ | D. | $\frac{2b-a-4c}{8}$kJ |
9.下列污水处理的方法、目的和离子方程式及其对应关系均正确的是( )
| 方法 | 目的 | 离子方程式 | |
| A | 中和法 | 用H2SO4中和碱性废水 | H++OH-═H2O |
| B | 混凝法 | 除去水中悬浮物 | Al3++H2O═Al(OH)3↓+H+ |
| C | 沉淀法 | 除去废水中的Hg2+ | Hg2++Na2S═HgS↓+Na+ |
| D | 氧化法 | 消毒 | Cl2+2OH-═Cl-+ClO-+H2O |
| A. | A | B. | B | C. | C | D. | D |
10.下列说法正确的是( )
| A. | 等质量的N2和C2H4体积一定相等 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
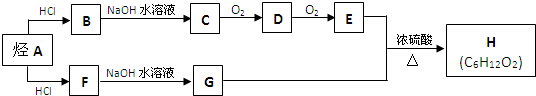
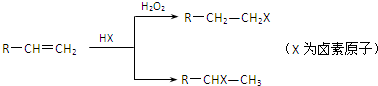
 CH3CH2COOCH(CH3)2+H2O.
CH3CH2COOCH(CH3)2+H2O. .(用结构简式表示)
.(用结构简式表示)