2. 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )| A. | $\root{3}{\frac{2M}{p{N}_{A}}}$cm | B. | $\root{3}{\frac{M}{2p{N}_{A}}}$cm | C. | $\root{3}{\frac{2{N}_{A}}{pM}}$cm | D. | $\root{3}{\frac{M}{8p{N}_{A}}}$cm |
1.下表给出几种氢化物的熔点和沸点:
有关表中所列四种氢化物的性质,以下叙述正确的是:( )
①氯化铝在加热时能升华,
②四氯化硅在晶态时属于分子晶体,
③氯化钠晶体中粒子之间以范德华力结合,
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式,键的极性、品格能等影响.
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
①氯化铝在加热时能升华,
②四氯化硅在晶态时属于分子晶体,
③氯化钠晶体中粒子之间以范德华力结合,
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式,键的极性、品格能等影响.
| A. | ② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
20.下面的排序不正确的是( )
| A. | 晶体熔点由低到高:F2<Cl2<Br2<I2 | |
| B. | 熔点由高到低:Rb>K>Na | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
19.以下关于晶体的说法中正确的是( )
| A. | 晶体根据结构和性质只可分为分子晶体,原子晶体,离子晶体和金属晶体四大类 | |
| B. | 含有阳离子的晶体一定是离子晶体,且离子晶体中可能含有共价键 | |
| C. | 任何晶体中部分含有化学键,如离子键、共价键、金属键、氢键等 | |
| D. | 原子晶体的熔沸点不一定高于离子晶体,而离子晶体的熔沸点肯定高于分子晶体 |
18.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
| A. | CCl4和PCl3 | B. | NaCl和HCl | C. | CO2和SiO2 | D. | NaH和Na2O2 |
17.等电子体之间往往具有相似的结构,N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是( )
| A. | N2O为三角形分子 | |
| B. | N2O与CO2均不含非极性键 | |
| C. | N2O的电子式可表示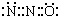 | |
| D. | N2O与SiO2为等电子体、具有相似的结构和相似性质 |
16.下列中心原子的杂化轨道类型和分子几何构型均正确的是( )
| A. | CS2中C原子sp2杂化,为V形 | |
| B. | BCl3中B原子sp2杂化,为三角锥形 | |
| C. | C2H2分子中,C为sp2杂化,为直线形 | |
| D. | PCl2中P原子sp2杂化,为平面三角形 |
15.下列说法中正确的是( )
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 碱性强弱:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<H2O |
14.下列离子中,半径最大的是( )
| A. | S2- | B. | N3- | C. | Cl- | D. | Mg2+ |
13.某元素原子价电子构型3d34s2,其应在( )
0 168741 168749 168755 168759 168765 168767 168771 168777 168779 168785 168791 168795 168797 168801 168807 168809 168815 168819 168821 168825 168827 168831 168833 168835 168836 168837 168839 168840 168841 168843 168845 168849 168851 168855 168857 168861 168867 168869 168875 168879 168881 168885 168891 168897 168899 168905 168909 168911 168917 168921 168927 168935 203614
| A. | 第四周期ⅤB族 | B. | 第四周期ⅡB组 | C. | 第四周期ⅦA族 | D. | 第四周期ⅦB族 |