题目内容
1.下表给出几种氢化物的熔点和沸点:| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
①氯化铝在加热时能升华,
②四氯化硅在晶态时属于分子晶体,
③氯化钠晶体中粒子之间以范德华力结合,
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式,键的极性、品格能等影响.
| A. | ② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
分析 根据表格中氯化物的熔沸点判断物质的晶体类型,一般离子晶体的熔沸点大于分子晶体的熔沸点.
解答 解:①由表格中的数据可知AlCl3的熔沸点较低,则AlCl3属于分子晶体,加热时能升华,故①正确;
②由表格中的数据可知SiCl4的熔沸点较低,则SiCl4是分子晶体,故②正确;
③由表格中的数据可知,NaCl的沸点为1413℃,则属于离子晶体,粒子之间以离子键结合,故③错误;
④由表格中的数据可知,氯化镁的熔沸点比氯化钠低,并且都属于离子晶体,所以主要是受堆积方式,键的极性、晶格能等影响,故④正确;
故选C.
点评 本题考查晶体类型与晶体熔沸点的关系,明确表格中的数据及一般离子晶体的熔沸点大于分子晶体的熔沸点是解答本题的关键,难度不大.

练习册系列答案
相关题目
11.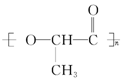 在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
 在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料(如图)能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸是一种羧酸 | |
| C. | 聚乳酸的单体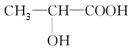 | |
| D. | 其聚合方式与聚苯乙烯的聚合方式相同 |
12.人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”.下列说法不正确的是( )
| A. | 目前研究菠菜蛋白质“发电”不属于“太阳能文明” | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 石油和天然气都属于碳素燃料 |
9.下列说法正确的是( )
| A. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| B. | 只要有能量的变化,一定发生了化学反应 | |
| C. | 所有的化学反应都有能量变化 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
16.下列中心原子的杂化轨道类型和分子几何构型均正确的是( )
| A. | CS2中C原子sp2杂化,为V形 | |
| B. | BCl3中B原子sp2杂化,为三角锥形 | |
| C. | C2H2分子中,C为sp2杂化,为直线形 | |
| D. | PCl2中P原子sp2杂化,为平面三角形 |
10.下列物质中既有离子键、又有共价键的是( )
| A. | C60 | B. | CaCl2 | C. | KF | D. | NH4Cl |
11.能正确表示下列反应的离子方程式是( )
| A. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH- $\stackrel{△}{→}$ CH2BrCOO-+H2O | |
| C. | 稀HNO3洗涤试管中的银镜:3Ag+NO3-+4H+=3Ag++NO↑+2H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |