题目内容
16.下列中心原子的杂化轨道类型和分子几何构型均正确的是( )| A. | CS2中C原子sp2杂化,为V形 | |
| B. | BCl3中B原子sp2杂化,为三角锥形 | |
| C. | C2H2分子中,C为sp2杂化,为直线形 | |
| D. | PCl2中P原子sp2杂化,为平面三角形 |
分析 首先判断中心原子形成的δ键数目,然后判断孤对电子数目,以此判断杂化类型,结合价层电子对互斥模型可判断分子的空间构型.
解答 解:A.CS2中C原子形成2个δ键,孤对电子数为$\frac{4-2×2}{2}$=0,则为sp杂化,为直线形,故A错误;
B.BCl3中B原子形成3个δ键,孤对电子数为$\frac{3-3×1}{2}$=0,则为sp2杂化,为平面三角形,故B错误;
C.乙炔分子中每个C原子含有2个δ键,且没有孤电子对,所以为sp杂化,为直线形结构,故C错误;
D.PCl3中P原子形成3个δ键,孤对电子数为$\frac{5-3×1}{2}$=1,则为sp3杂化,为三角锥形,故D正确;
故选D.
点评 本题考查原子杂化方式判断及微粒空间构型判断,为高频考点,明确价层电子对互斥理论是解本题关键,难点是孤电子对的计算方法,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
7.下列有关图象说法正确的是( )
| A. | 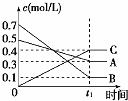 表示反应的方程式为5A(g)+7B(g)?4C(g) | |
| B. | 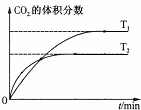 表示反应5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0 | |
| C. | 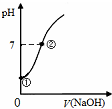 表示向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液的pH 变化,①到②水的电离程度逐渐减小 | |
| D. | 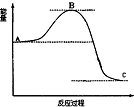 表示4H2(g)+2NO2(g)=N2(g)+4H2O(g)反应过程的能量变化,加入催化剂,将使C 点降低 |
4.下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
| A. | CH3-CHCl-CH2-CH3 | B. | 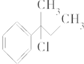 | ||
| C. | CH3-C(CH3)Cl-CH2-CH3 | D. | 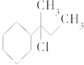 |
11.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层是最外层电子数的2倍,则关于A、B元素的判断正确的( )
| A. | A和B元素一定都是第二周期元素 | B. | A和B元素一定是同一主族元素 | ||
| C. | B元素可以是第二周期VIA族元素 | D. | A和B可以相互化合形成化合物 |
1.下表给出几种氢化物的熔点和沸点:
有关表中所列四种氢化物的性质,以下叙述正确的是:( )
①氯化铝在加热时能升华,
②四氯化硅在晶态时属于分子晶体,
③氯化钠晶体中粒子之间以范德华力结合,
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式,键的极性、品格能等影响.
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
①氯化铝在加热时能升华,
②四氯化硅在晶态时属于分子晶体,
③氯化钠晶体中粒子之间以范德华力结合,
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式,键的极性、品格能等影响.
| A. | ② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
8.下列关于化学键的说法正确的是( )
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 非极性键只存在于双原子分子中 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
5.下列反应产物中,一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 丁烷与氯气光照条件下生成的一氯代物 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 2-丁烯与水的加成反应 |
6.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | CCl4 | B. | BF3 | C. | HClO | D. | H2O |