题目内容
17.等电子体之间往往具有相似的结构,N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是( )| A. | N2O为三角形分子 | |
| B. | N2O与CO2均不含非极性键 | |
| C. | N2O的电子式可表示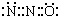 | |
| D. | N2O与SiO2为等电子体、具有相似的结构和相似性质 |
分析 A.根据二氧化碳的空间构型判断N2O的空间构型;
B.分子中同种元素之间存在非极性键;
C.根据二氧化碳的电子式结合题意写出N2O的电子式;
D.根据N2O和二氧化硅的晶体类型判断其结构是否相似;
解答 解:A.N2O与CO2分子具有相似的结构,二氧化碳是直线型分子,所以N2O是直线型分子,故A错误;
B.N2O的电子式为: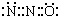 ,N2O中存在氮氮键,所以含有非极性键,故B错误;
,N2O中存在氮氮键,所以含有非极性键,故B错误;
C.二氧化碳的电子式为: ,N2O与CO2分子具有相似的结构(包括电子式),且N2O分子中氧原子只与一个氮原子相连,所以N2O的电子式为:
,N2O与CO2分子具有相似的结构(包括电子式),且N2O分子中氧原子只与一个氮原子相连,所以N2O的电子式为: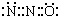 ,故C正确;
,故C正确;
D.二氧化硅是原子晶体,N2O是分子晶体,二氧化硅中电子数是30,N2O中电子数是22,所以N2O和SiO2不是等电子体,其结构不同,故D错误;
故选C.
点评 本题以元素化合物知识为载体考查了学生知识迁移的能力,根据已知物质的信息来分析解答N2O的有关问题即可,题目难度不大.

练习册系列答案
相关题目
5.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
| A. |
| B. |
| C. |
| D. |
|
2. 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
 食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )
食盐晶体如图所示,已知食盐的密度为ρg/cm3,NaCl摩尔质量Mg/mol,阿伏伽德罗常数为NA,则在食盐晶体里Na+和Cl-的间距大约是( )| A. | $\root{3}{\frac{2M}{p{N}_{A}}}$cm | B. | $\root{3}{\frac{M}{2p{N}_{A}}}$cm | C. | $\root{3}{\frac{2{N}_{A}}{pM}}$cm | D. | $\root{3}{\frac{M}{8p{N}_{A}}}$cm |
9.含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫强 | B. | 原子序数为34 | ||
| C. | 氢化物比HBr稳定 | D. | 最高价氧化物的水化物显碱性 |
6.现有烃的含氧衍生物A,还原A时得醇B,氧化A时得C,由B、C反应可生成高分子化合物,其结构简式为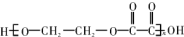 ,以下叙述错误的是( )
,以下叙述错误的是( )
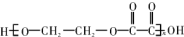 ,以下叙述错误的是( )
,以下叙述错误的是( )| A. | A属于醛类 | |
| B. | A有相对分子质量为58 | |
| C. | A分子中有6个原子含C 40% | |
| D. | 1molA与足量银氨溶液反应还原出4molAg |
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时正极反应为:FeO${\;}_{4}^{2-}$+4H2O+3e-═Fe(OH)3+5OH- | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答: .
.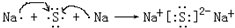 .
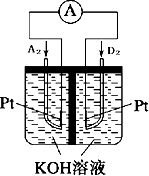
. 为了验证铜与稀硝酸反应产生的是一氧化氮而不是氢气.某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;C中有足量的澄清石灰水,E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了验证铜与稀硝酸反应产生的是一氧化氮而不是氢气.某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;C中有足量的澄清石灰水,E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.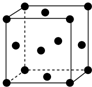 (1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.
(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.