题目内容
19.以下关于晶体的说法中正确的是( )| A. | 晶体根据结构和性质只可分为分子晶体,原子晶体,离子晶体和金属晶体四大类 | |
| B. | 含有阳离子的晶体一定是离子晶体,且离子晶体中可能含有共价键 | |
| C. | 任何晶体中部分含有化学键,如离子键、共价键、金属键、氢键等 | |
| D. | 原子晶体的熔沸点不一定高于离子晶体,而离子晶体的熔沸点肯定高于分子晶体 |
分析 A.根据晶体的构成微粒将晶体分为四类;
B.含有阳离子的晶体不一定是离子晶体,离子晶体中一定含有离子键,可能含有共价键;
C.单原子分子中不含化学键;
D.原子晶体的熔沸点不一定高于离子晶体,如MgO的熔点为2852℃,而SiO2的熔点为1710℃;而离子晶体的熔沸点较高、分子晶体熔沸点较低.
解答 解:A.根据晶体的构成微粒将晶体分为分子晶体、原子晶体、离子晶体和金属晶体四类,故A错误;
B.含有阳离子的晶体不一定是离子晶体,如金属晶体;离子晶体中一定含有离子键,可能含有共价键,如KOH,故B错误;
C.单原子分子中不含化学键,且氢键是分子间作用力而不是化学键,故C错误;
D.原子晶体的熔沸点不一定高于离子晶体,如MgO的熔点为2852℃,而SiO2的熔点为1710℃;而离子晶体的熔沸点较高、分子晶体熔沸点较低,所以离子晶体的熔沸点肯定高于分子晶体,故D正确;
故选D.
点评 本题考查化学键与晶体及晶体熔沸点之间关系,侧重考查分析判断能力,知道常见晶体类型及分类方法,易错选项是C,注意稀有气体中不含化学键,注意氢键属于分子间作用力,配位键属于共价键,为易错点.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
7.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: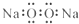 | |
| B. | 硫离子的结构示意图: | |
| C. | NH4Cl的电子式: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
14.下列离子中,半径最大的是( )
| A. | S2- | B. | N3- | C. | Cl- | D. | Mg2+ |
4.如图是元素周期表的一部分.
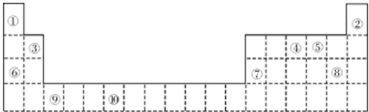
(1)元素⑤的未成电子数为2.
(2)如果在温度接近373K时,根据M=$\frac{m}{n}$测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是分子间存在氢键,H2O分子发生缔合
(3)要证明太阳上是否含有②元素,可采用的方法是光谱分析.
(4)某些不同族元素的性质也有一定的相似性,加上表中元素⑦与元素③的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的离子方程式2OH-+Be(OH)2=BeO22-+2H2O.
(5)根据下列五种元素的第一至第四电力能数(单位:kJ•mol-1).回答下面各题:
(Ⅰ)在周期表中,最可能处于同一主族的是R和U(填匀速代号)
(Ⅱ)T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素,位于IIIA族;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(6)⑩元素M能形成化合物(MO2Cl2).请回答下列问题:
(Ⅰ)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有K、Cu(填元素符号)
(Ⅱ)MO2Cl2常温下为深红色液体,能与CCl2、CS2等互溶,据此可判断MO2Cl2是非极性(填“极性”或“非极性”)分子.

(1)元素⑤的未成电子数为2.
(2)如果在温度接近373K时,根据M=$\frac{m}{n}$测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是分子间存在氢键,H2O分子发生缔合
(3)要证明太阳上是否含有②元素,可采用的方法是光谱分析.
(4)某些不同族元素的性质也有一定的相似性,加上表中元素⑦与元素③的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的离子方程式2OH-+Be(OH)2=BeO22-+2H2O.
(5)根据下列五种元素的第一至第四电力能数(单位:kJ•mol-1).回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(Ⅱ)T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素,位于IIIA族;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(6)⑩元素M能形成化合物(MO2Cl2).请回答下列问题:
(Ⅰ)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有K、Cu(填元素符号)
(Ⅱ)MO2Cl2常温下为深红色液体,能与CCl2、CS2等互溶,据此可判断MO2Cl2是非极性(填“极性”或“非极性”)分子.
11.下列有机物的系统命名中正确的是( )
| A. | 3-甲基-4-乙基戊烷 | B. | 2,3-二甲基戊烷 | ||
| C. | 3,4,4-三甲基已烷 | D. | 3,5-二甲基已烷 |
8. 节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
 节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )| A. | 倡导开私家车的人乘公交车上下班 | |
| B. | 用节能灯代替白炽灯 | |
| C. | 政府鼓励科研和生产部门开发、利用太阳能 | |
| D. | 加快开发石油以缓解能源紧张问题 |
9.在共价化合物中,成键原子通过共用电子对形成共价键共用电子对由双方共同提供并且共同分享,那么,在共价化合物中元素化合价有正负之分的主要原因是( )
| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有偏移 | D. | 金属元素的存在 |
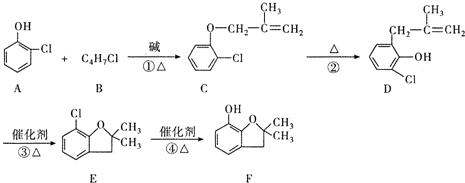
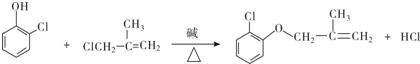 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).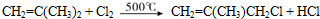
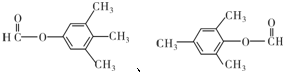

 .
. .
.