题目内容
14.下列离子中,半径最大的是( )| A. | S2- | B. | N3- | C. | Cl- | D. | Mg2+ |
分析 电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答 解:N3-、Mg2+离子均含有2个电子层,S2-、Cl-离子均含有三个电子层,电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->N3->Mg2+,故选A.
点评 本题考查微粒半径比较,比较基础,注意掌握微粒半径比较规律,有利于基础知识的巩固.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| B. | 只要有能量的变化,一定发生了化学反应 | |
| C. | 所有的化学反应都有能量变化 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
19.以下关于晶体的说法中正确的是( )
| A. | 晶体根据结构和性质只可分为分子晶体,原子晶体,离子晶体和金属晶体四大类 | |
| B. | 含有阳离子的晶体一定是离子晶体,且离子晶体中可能含有共价键 | |
| C. | 任何晶体中部分含有化学键,如离子键、共价键、金属键、氢键等 | |
| D. | 原子晶体的熔沸点不一定高于离子晶体,而离子晶体的熔沸点肯定高于分子晶体 |
3.只用一种试剂,区别甲苯、四氯化碳、已烯、水四种无色液体,应选用( )
| A. | 酸性KMnO4溶液 | B. | 溴水 | C. | 乙醇 | D. | 硝酸银溶液 |
4.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,正确的是( )
| A. | 原子半径:X>Y>Z>W | B. | 金属性:X<Y,还原性:W 2->Z- | ||
| C. | 原子最外层电子数:Y>X>Z>W | D. | 原子序数:Y>X>Z>W |
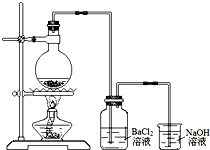 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.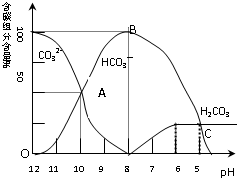 常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:
常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题: