题目内容
15.下列说法中正确的是( )| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 碱性强弱:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<H2O |
分析 A、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体;
D、水分子和氨分子之间存在氢键,沸点最高.
解答 解:A、非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性HIO4<HBrO4<HClO4,故A错误;
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:K>Ba>Ca,则碱性:Ca(OH)2<Ba(OH)2<KOH,故B错误;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体,所以熔点:BN>MgBr2>SiCl4,故C错误;
D、含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:PH3<NH3<H2O,故D正确;
故选D.
点评 本题考查了元素性质的递变规律,题目难度不大,注意把握非金属元素的性质的变化规律.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
5.下列各装置中能构成原电池的是( )
| A. | 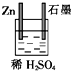 | B. | 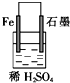 | C. | 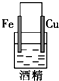 | D. |  |
10.下列反应中属于吸热反应的是( )
| A. | 甲烷燃烧 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝片与盐酸反应 | D. | 氧化钙与水反应 |
20.下面的排序不正确的是( )
| A. | 晶体熔点由低到高:F2<Cl2<Br2<I2 | |
| B. | 熔点由高到低:Rb>K>Na | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
4.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 聚乙烯、聚乙炔都不能使酸性高锰酸钾褪色 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 光照下2,2-二甲基丙烷与Br2反应,其中一溴取代物只有一种 |
5.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
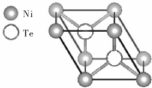 氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题:
氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题: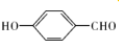 的沸点比
的沸点比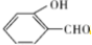 高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.
高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.