16.利用铜萃取剂M,通过如图甲所示反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
(6)某Y原子的价电子排布式是3s23p5,铜与Y形成的化合物的晶胞结构如图丙;
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).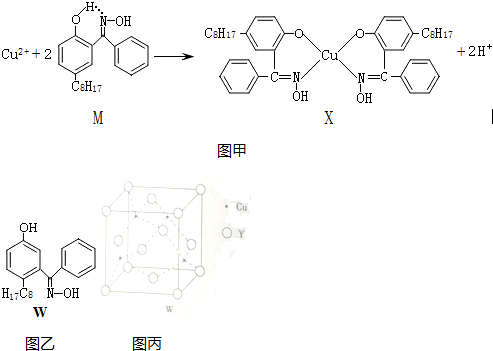
(1)X难溶于水、易溶于有机溶剂,其晶体类型为分子晶体.
(2)M所含元素的电负性由大到小顺序为O>N>C>H,分子中碳原子的杂化方式有sp2、sp3.
(3)上述反应中断裂和生成的化学键有be(填序号).
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图乙)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(5)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
①晶体的化学式是CuCl.
②已知该晶体的密度为ρg•cm-3,阿伏伽德罗常数的值为NA,则该晶体中铜原子与Y原子之间的最短距离为=$\frac{\sqrt{3}}{4}\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).

14.碳及其化合物的开发利用已成为科学家研究的重要课题,在工农业生产和科学研究中有十分重要的地位.
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
(1)温度T2>T1的理由是甲乙两容器中反应物浓度相同,乙达到平衡所有时间短,说明T2温度高.
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
13.控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )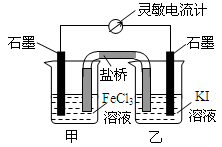

| A. | 反应开始时,甲池中电极反应为Fe3++e-=Fe2+ | |
| B. | 反应开始时,盐桥中的阴离子向乙池迁移 | |
| C. | 反应处于化学平衡状态时,甲、乙两池中离子浓度不再变化 | |
| D. | 反应处于化学平衡状态时,电子沿着石墨(乙池)→电流计→石墨(甲池)路径流动 |
12.常温下,下列对于溶液问题的叙述正确的是( )
| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
11.下列有关实验仪器的使用及实验操作正确的是( )
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 配制0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O晶体 |
10.下列关于有机物同分异构体的说法正确的是( )
| A. | C4H10的二氯取代物有4种 | |
| B. | 最简式为C2H5的烃结构简式有5种 | |
| C. | 乙苯的一氯取代物只有3种 | |
| D. | 分子式为C4H10O且与钠反应的有机物有4种 |
9.化学与社会、生产、生活密切相关,下列说法正确的是( )
0 168636 168644 168650 168654 168660 168662 168666 168672 168674 168680 168686 168690 168692 168696 168702 168704 168710 168714 168716 168720 168722 168726 168728 168730 168731 168732 168734 168735 168736 168738 168740 168744 168746 168750 168752 168756 168762 168764 168770 168774 168776 168780 168786 168792 168794 168800 168804 168806 168812 168816 168822 168830 203614
| A. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| B. | 研发易降解的生物农药有利于环境保护 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 常用无水酒精来消毒,是因为酒精能够使细菌蛋白发生变性 |
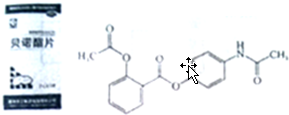
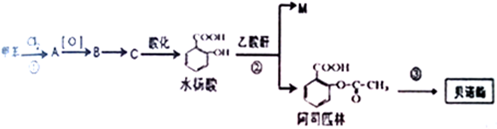
 .
.
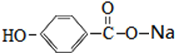 的化学试剂是NaHCO3(写化学式).
的化学试剂是NaHCO3(写化学式). ,E转化为F的化学反应类型是酯化反应或取代反应.
,E转化为F的化学反应类型是酯化反应或取代反应. +3NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl+
+3NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl+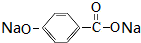 +H2O.
+H2O. .
.