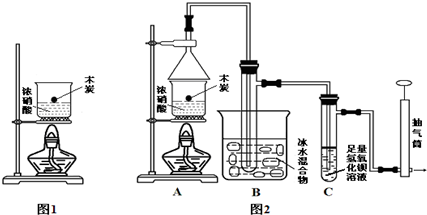
题目内容
12.常温下,下列对于溶液问题的叙述正确的是( )| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
分析 A、氯化铵溶液中铵根离子水解,加水稀释促进水解,氢离子物质的量增大;
B、据电荷守恒分析;
C、若HA为强酸,pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,恰好中和,若HA为弱酸,pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,HA过量;
D、NaOH能够抑制水的电离,NaClO水解能够促进水的电离.
解答 解:A、氯化铵溶液中铵根离子水解,加水稀释促进水解,氢离子物质的量增大,所以pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH<5,故A错误;
B、据电荷守恒,在pH=3的盐酸与pH=3的CH3COOH溶液中,c(Cl-)=C(CH3COO-)>c(OH-)=C(H+),故B错误;
C、若HA为强酸,pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,恰好中和,c(Na+)=c(A-);若HA为弱酸,pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,HA过量,溶液显酸性,据电荷守恒c(Na+)<c(A-),故C正确;
D、NaOH能够抑制水的电离,NaClO水解能够促进水的电离,所以pH相同的NaOH、NaClO两种溶液中水的电离程度不相同,故D错误;
故选C.
点评 本题考查了盐类水解、溶液中的电荷守恒、水的电离等等,题目难度不大,注意影响水的电离平衡移动的因素.

练习册系列答案
相关题目
2.电解法是处理工业废水的一种重要方法.如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理.电解时采用Fe作阳极,惰性电极作阴极.已知:①氧化性:Cr2O72->Fe3+;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31.下列说法正确的是( )
| A. | 阳极材料也可以是Cu | |
| B. | 阴极每产生3molH2,则有1mol Cr2O72-被还原 | |
| C. | 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
3.如图是部分短周期主族元素原子半径与原子序数的关系图.字母代表元素,下列有关分析正确的是( )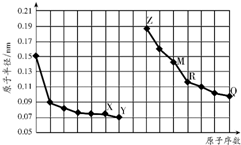

| A. | R在周期表的第14列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
2. 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |

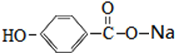 的化学试剂是NaHCO3(写化学式).
的化学试剂是NaHCO3(写化学式). ,E转化为F的化学反应类型是酯化反应或取代反应.
,E转化为F的化学反应类型是酯化反应或取代反应. +3NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl+
+3NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl+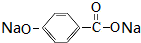 +H2O.
+H2O. .
.