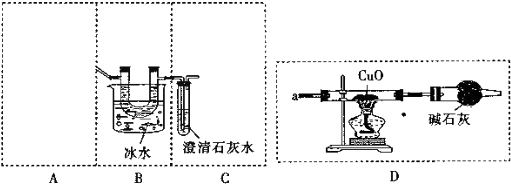
题目内容
15.水处理技术在生产、生活中应用广泛.(1)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用.
①硬水软化的方法通常有热煮沸法、药剂法和离子交换法.离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力,把CaR2(或MgR2)型树脂置于5%-8%的食盐水中浸泡一段时间,便可再生.
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,洗衣粉洗涤效果较好,原因是肥皂易与Ca2+,Mg2+生成沉淀.
(2)下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是c(填字母).
a.福尔马林 b.漂白粉 c.臭氧 d.氯气
(3)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4,其工艺流程如下:

①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾.请解释这一做法的原因Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-═4Fe(OH)3(胶体).(用必要的离子方程式和文字描述)
②设每步反应均是完全的,若制取3molNa2FeO4,需要NaClO固体335.25g.
③写出第一步在酸性环境下加入H2O2的离子反应方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)若生活污水中含大量含氮化合物,通常用生物膜脱氮工艺进行处理.首先在消化细菌作用下将NH4+氧化为NO3-,然后加入甲醇与NO3-反应生成N2.请写出加入甲醇后反应的离子方程式6NO3-+5CH3OH═3N2+5CO2+7H2O+6OH-.
分析 (1)①硬水软化的方法通常有①热煮沸法②药剂软化法③蒸馏法④离子交换法⑤电渗析法⑥离子膜电解法;
用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;
②肥皂易与Ca2+,Mg2+生成沉淀,洗涤效果不好;
(2)对自来水进行杀菌消毒,且不会造成二次污染,只有臭氧的还原产物对水无污染;
(3)①将待处理水的pH调到9左右,再加入绿矾,可得到铁离子,水解生成胶体;
②发生氧化还原反应生成Na2FeO4;
③H202在酸性条件下能将Fe2+氧化为Fe3+,H202被还原为水,据此写出离子方程式;
(4)加入甲醇与NO3-反应生成N2,N元素的化合价降低,C元素的化合价升高,结合电子、电荷守恒来解答.
解答 解:(1)①硬水软化的方法通常有①热煮沸法②药剂软化法③蒸馏法④离子交换法⑤电渗析法⑥离子膜电解法;用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;
故答案为:热煮沸法;药剂法;5%-8%的食盐水;
②肥皂易与Ca2+,Mg2+生成硬脂酸钙、硬脂酸镁沉淀,洗涤效果不好,洗衣粉不与Ca2+,Mg2+生成沉淀,洗涤效果较好,
故答案为:洗衣粉;肥皂易与Ca2+,Mg2+生成沉淀;
②福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,故答案为:c;
(3)①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)3(胶体),
故答案为:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-═4Fe(OH)3(胶体);
②设需要的NaClO的物质的量为xmol,
由Fe(0H)3制取Na2FeO4的化学方程式为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,
2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O
3 2
xmol 3mol
可得$\frac{3}{x}=\frac{2}{3}$,解得x=4.5mol,
则NaClO的质量m=nM=4.5mol×74.5g/mol=335.25g,
故答案为:335.25;
③H202在酸性条件下能将Fe2+氧化为Fe3+,H202被还原为水,故离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)硝化细菌的作用下将NH4+氧化为NO3-,NH4+中的N元素价态由-3价变化到NO3-中的+5价,价态升高8,氧气由0价变化到-2价,价态降低2,又因为氧气为双原子分子,所以NH4+离子与臭氧的化学计量数之比为1:2,结合电荷守恒得离子方程式为:NH4++2O2=NO3-+2H++H2O;
甲醇和硝酸根反应生成氮气、二氧化碳、水,NO3-中的N元素由+5价变化到氮气中的0价,甲醇中C元素的价态由-2价变化到二氧化碳中的+4价,所以NO3-与甲醇的化学计量数之比为6:5,结合电荷守恒得离子方程式为:6NO3-+5CH3OH═3N2+5CO2+7H2O+6OH-,
故答案为:6NO3-+5CH3OH═3N2+5CO2+7H2O+6OH-.
点评 本题考查较综合,涉及离子反应、物质制备实验、氧化还原反应等,为高频考点,把握反应原理为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| B. | 某溶液中存在大量Fe3+、S2-、Cl-、Na+,加入NaOH溶液发生反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 向AlCl3溶液中投入过量的Na:Na+Al3++2H2O=Na++AlO2-+2H2↑ | |
| D. | 将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑ |
| A. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
| A. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| B. | 乙醇、次氯酸钠和二氧化硫分别属于非电解质、强电解质和弱电解质 | |
| C. | Na、Al、Cu通常分别用电解法、热分解法和置换法冶炼得到 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
| A. | C4H10的二氯取代物有4种 | |
| B. | 最简式为C2H5的烃结构简式有5种 | |
| C. | 乙苯的一氯取代物只有3种 | |
| D. | 分子式为C4H10O且与钠反应的有机物有4种 |
 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
(1)写出NaHCO3和盐酸发生反应的离子方程式HCO3-+H+=CO2↑+H2O
(2)由上述实验得出的结论是:Na2CO3溶液与盐酸的反应是放热(填“吸热”或“放热”下同)反应,NaHCO3溶液与盐酸反应是吸热反应
(3)在如图中画出Na2CO3和盐酸反应前后能量变化曲线(标注“反应物总能量”和“生成物总能量”)
 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
(2)ACl2分子中A的杂化类型为sp杂化.
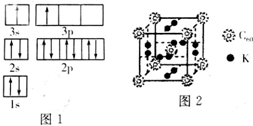
(3)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.基态钾原子的价电子排布式为4S1,该物质中K原子和C60分子的个数比为3:1.
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的价层电子对互斥理论模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则分子中π键的数目为30.