16.在下列有关晶体的叙述中错误的是( )
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |
15.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:NaCl>Na>CO2 |
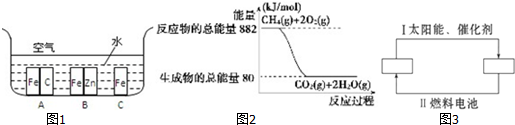
13.根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
| 化学键 | H-H | H-Cl | H-I | Cl-Cl | Br-Br |
| 键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
10.下列化合物中既含有离子键又含有极性共价键的是( )
| A. | MgCl2 | B. | H2O | C. | K2O2 | D. | NaOH |
9.下列说法中错误的是( )
| A. | 质量数相同的不同原子,其化学性质一定相同 | |
| B. | 质子数相同的原子,其核外电子排布也相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
8.下列各组给定原子序数的元素,不能形成原子个数之比为1:1共价化合物的是( )
| A. | 3和17 | B. | 1和8 | C. | 6和8 | D. | 7和12 |
7.下列各组液体只用一种试剂无法鉴别的是( )
0 168106 168114 168120 168124 168130 168132 168136 168142 168144 168150 168156 168160 168162 168166 168172 168174 168180 168184 168186 168190 168192 168196 168198 168200 168201 168202 168204 168205 168206 168208 168210 168214 168216 168220 168222 168226 168232 168234 168240 168244 168246 168250 168256 168262 168264 168270 168274 168276 168282 168286 168292 168300 203614
| A. | 乙醇、甲苯、硝基苯 | B. | 苯、苯酚、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 苯酚、硫氰化钾溶液、氢氧化钠溶液 |