题目内容
14.(1)在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重大问题.兴趣小组的同学在实验室对金属腐蚀进行了探究.如图1所示,铁处于A、B、C三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号):A>C>B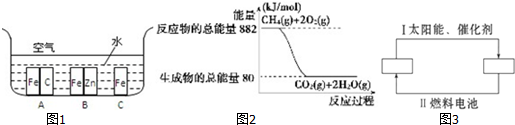
(2)天然气的主要成分是甲烷(CH4),甲烷燃烧时的能量变化如图2所示.已知H2O (l)?H2O(g)△H=+44kJ/mol,写出甲烷完全燃烧生成CO2和液态水的热化
学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol
(3)氢能是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环利用.
①请在图3的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
②从能量转移的角度看,过程Ⅱ主要是化学能转化为电能.
③绿色化学提倡化工生产应提高原子利用率,原子利用率表示目标产物的质量与生成物的总质量之比.将CO2转化为有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.CO2+CH4$→_{△}^{催化剂}$CH3COOH
b.2CO2+6H2$→_{△}^{催化剂}$H2C═CH2+4H2O
c.6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
d.CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
以上反应中,最节能的是C,原子利用率最高的是B.
分析 (1)金属腐蚀的速度:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀;
(2)根据图示写出1 mol CH4完全燃烧生成气态水时的热化学方程式,然后结合每摩尔水由气态变为液态时放出44kJ,根据盖斯定律来解答;
(3)①分析转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气;
②过程Ⅱ是发生的原电池反应;
③根据题中信息绿色化学的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知化合反应、加成反应符合绿色化学的要求;需要的条件越简单,越节能.
解答 (1)解:铁处于A的环境中做原电池的负极,腐蚀速率较快,铁处于B的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于C的环境中的金属铁发生吸氧腐蚀,速度较慢.
故答案为:A>C>B;
(2)由图知1 mol CH4完全燃烧生成气态水时放出热量为(882-80)kJ=802 kJ,
热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol①
又知每摩尔水由气态变为液态时放出44kJ:H2O(g)=H2O(l)△H=-44KJ/mol②
根据盖斯定律,将①+②×2可得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=(-802 kJ/mol)+2×(-44KJ/mol)=-890 kJ/mol
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol;
(3)①转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气,两个框中的X、Y为循环过程中反应物和生成物的分子式为:左边为H2O;右边为H2、O2;
故答案为:左边为H2O;右边为H2、O2;
②过程Ⅱ是发生的原电池反应,能量变化是化学能转化为电能的过程;
故答案为:化学;电;
③C需要的条件是自然界中存在的太阳光,其他反应需要特定的催化剂,所以C最节能,根据题中信息绿色化学的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知C是化合反应,原子利用率最高.
故答案为:C;B.
点评 本题考查学生金属的腐蚀速率快慢比较、盖斯定律的应用和反应热的求算、化学反应过程中能量变化形式、原电池原理的分析应用等知识,难度不大,综合性强.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案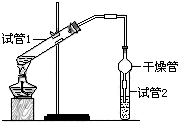 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实验室制备乙酸乙酯反应中起催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
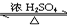 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)干燥管在上述实验中的作用冷凝,防倒吸.
(3)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(4)分析实验AC(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收产物中的水,使平衡向生成乙酸乙酯方向移动.
①CH3CHO ②CH3CH2CH2CH2OH ③(CH3)3CH ④CH3CH2CH2CH3.
| A. | ②④①③ | B. | ②①④③ | C. | ①②③④ | D. | ①②④③ |
| A. | 质量数相同的不同原子,其化学性质一定相同 | |
| B. | 质子数相同的原子,其核外电子排布也相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
| A. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| B. | 乙醇、苯酚都有羟基,但是电离常数不同 | |
| C. | 苯酚无需催化剂即能与溴水发生取代反应 | |
| D. | 1 mol甲苯能与3 mol H2发生加成反应 |

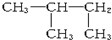



 ,其合成过程中涉及的反应类型分别是( )
,其合成过程中涉及的反应类型分别是( )
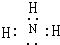 ,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.