题目内容
15.下列各组顺序的排列不正确的是( )| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:NaCl>Na>CO2 |
分析 A、电子层相同核电荷数越多半径越小;
B、非金属性越强氢化物越稳定;
C、非金属性越强,对应最高价氧化物的水化物的酸性越强;
D、NaCl熔点为801℃,Na熔点为98℃,CO2熔点为-56.6°C(5270帕).
解答 解:A、钠镁铝位于第三周期,电子层相同,铝的核电荷数最大,钠最小,所以原子半径:Na>Mg>Al,故A错误;
B、非金属性:Cl>S>P,氢化物的稳定为:HCl>H2S>PH3,故B正确;
C、非金属性:Si<C<S,对应最高价氧化物的水化物的酸性:H2SiO4<H2CO3<H2SO4,故C正确;
D、NaCl熔点为801℃,Na熔点为98℃,CO2熔点为-56.6°C(5270帕),所以熔点:NaCl>Na>CO2,故D正确;
故选A.
点评 本题考查金属性和非金属性,明确物质的酸性、气态氢化物的稳定性,碱性与非金属性、金属性的关系是解答本题的关键,难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
11.室温下,下列叙述正确的是( )
| A. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液,NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(${HCO}_{3}^{-}$)-c(${CO}_{3}^{2-}$) | |
| B. | pH=2是HA酸溶液与pH=12的MOH碱溶液等体积混合:c(M+)=c(OH-)>c(H+)=c(A-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(H{CO}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水②10mL0.2mol/LMgCl2③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
6.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯酚钠溶液中通入少量CO2,可以生成苯酚和碳酸钠 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2─二甲基丙烷与Br2反应,其一溴取代物只有一种 |
3.除去FeCl2溶液中少量的FeCl3,最好的办法是( )
| A. | 加入氢氧化钠溶液 | B. | 加入铁粉 | ||
| C. | 加入铜粉 | D. | 通入氯气 |
10.下列化合物中既含有离子键又含有极性共价键的是( )
| A. | MgCl2 | B. | H2O | C. | K2O2 | D. | NaOH |
4. 如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )
 如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )| A. | Janusene的分子式为C30H24 | |
| B. | Janusene属于苯的同系物 | |
| C. | Janusene苯环上的一氯代物有6种 | |
| D. | Janusene既可使酸性高锰酸钾褪色,又可与H2发生加成反应 |
5.下列微粒的立体结构与NH3相同的是( )
| A. | H2O | B. | H3O+ | C. | CH4 | D. | CO2 |
 W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题: ,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).
,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).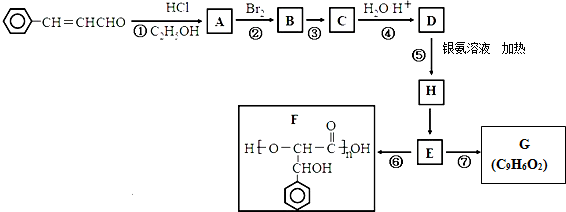
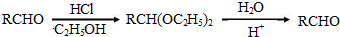
 .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$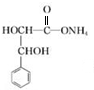 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. .(任写一种)
.(任写一种)