题目内容
11.工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别.路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
(1)写出N2的一种用途做保护气(或保存粮食、制氨气等).
(2)实验室制取物质NH3的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)写出工业制硝酸第③步反应化学方程式3NO2+H2O=2HNO3+NO.
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO. 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO.
(ⅰ) 请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
该反应中发生氧化反应的物质是Cu,1mol氧化剂得到(填“得到”或“失去”)1 mol电子.
(ⅱ) 48.0g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是C
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
(ⅲ) 实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等.请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式.
HNO3+FeSO4+→Fe(NO3)3+Fe2(SO4)3+N2O↑+H2O
并配平其对应的离子方程式:□Fe2++□NO3-+□H+=□Fe3++□N2O↑+□H2O.
分析 (1)氮气的化学性质比较稳定,故可用氮气做保护气、保存粮食、制氨气等;
(2)实验室中用氢氧化钙和氯化铵加热反应制取氨气,写出该反应的化学方程式;
(3)工业制硝酸第③步为二氧化氮与水反应生成硝酸和一氧化氮;
(4)(ⅰ)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;所含元素化合价升高的物质发生氧化反应;氧化剂获得电子,发生还原反应,结合N元素化合价变化计算转移电子;
(ⅱ)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,这两部分硝酸的质量即为消耗的硝酸的质量;
(ⅲ)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平完成方程式,再改写成离子方程式.
解答 解:(1)由于氮气的化学性质比较稳定,焊接金属时可以用氮气做保护气,储存粮食时也可以用氮气代替空气,避免粮食变质,工业合成氨中以氮气为原料,
故答案为:做保护气(或保存粮食、制氨气等);
(2)实验室中用氢氧化钙与氯化铵加热反应生成氯化钙、氨气和水,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)工业制硝酸第③步反应为二氧化氮与水反应生成硝酸,反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(4)(ⅰ)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
反应中Cu元素化合价升高,发生氧化反应,硝酸是氧化剂,获得电子,其化合价由+5降低为+4,故1mol硝酸完全其氧化剂作用,转移电子为1mol,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;Cu;得到; 1;
(ⅱ)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,
n(气体)=$\frac{22.4L}{22.4L/mol}$=1mol,即被还原的硝酸的物质的量为1mol,
n(Cu)=$\frac{48g}{64g/mol}$=0.75mol,则生成n[Cu(NO3)2]=0.75mol,可知表现酸性的硝酸的物质的量为0.75mol×2=1.5mol,
则参加反应的硝酸的物质的量为:1.0mol+1.5mol=2.5mol,
故答案为:C;
(ⅲ) 所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,改写成离子方程式为:8Fe2++2NO3-+10H+=8Fe3++N2O↑+5H2O,
故答案为:FeSO4;→Fe(NO3)3+Fe2(SO4)3;8;2;10;8;1;5.
点评 本题考查氧化还原反应基本概念、计算与配平及含氮化合物的综合应用等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算能力,注意掌握氧化还原反应的配平方法,明确含氮化合物的知识及其应用.

| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
| A. | ⅤA 族元素的化合物 | B. | ⅢB族元素的化合物 | ||
| C. | 过渡元素的化合物 | D. | ⅣA 族元素的化合物 |
| A. | 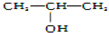 | B. | 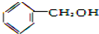 | C. | CH3OH | D. | 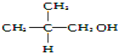 |
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |
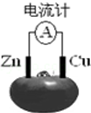
| A. | 锌电极为电池的正极 | |
| B. | 铜电极发生氧化反应 | |
| C. | 工作一段时间后,锌片质量会减轻 | |
| D. | 电池工作时,铜电极附近会出现蓝色 |
| A. | 原子半径逐渐增大 | |
| B. | 单质熔、沸点逐渐降低 | |
| C. | 单质的氧化性逐渐增强 | |
| D. | 最高价氧化物的水化物的酸性逐渐增强 |