题目内容
12.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图: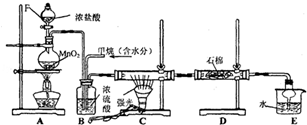
根据要求填空:
(1)实验室制取Cl2的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)写出CH4与Cl2生成一氯代物的化学反应方程式CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl.取代反应
(3)B装置有三种功能:①控制气体流速;②将气体混合均匀;③干燥混合气体.
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为分液.
(5)该装置还有缺陷,原因是没有进行尾气处理,尾气的主要成分是AB(填编号).
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4.
分析 (1)二氧化锰与浓盐酸在加热条件制备氯气;
(2)甲烷与氯气在光照条件下发生取代反应;
(3)浓硫酸具有吸水性,可以干燥氯气和氯化氢;
(4)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,三种取代物都不溶于水;
(5)氯气与甲烷反应生成产物中氯化氢、一氯甲烷为气体,其余为液态.
解答 解:(1)二氧化锰与浓盐酸在加热条件反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)甲烷与氯气在光照条件下发生取代反应,第一步反应生成一氯甲烷和氯化氢,化学方程式:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(3)浓硫酸具有吸水性,可以干燥氯气和氯化氢,所以B装置还能用来干燥混合气体,故答案为:干燥混合气体;
(4)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开,
故答案为:分液;
(5)甲烷与氯气发生取代反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,故选AB.
点评 本题考查甲烷和氯气的取代反应、氯气的实验室制法,明确甲烷发生取代反应的原理及得到氯代烷的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
3.下列说法中不正确的是( )
| A. | 原子晶体的熔点一定比分子晶体高 | |
| B. | SO2和SO3均是非极性分子 | |
| C. | PCl3分子中P-Cl的键角小于109°28? | |
| D. | 晶体中有阳离子必有阴离子 |
20.下列有机物分子中有三种不同的氢原子,且氢原子个数之比为3:2:1的是( )
| A. | CH3CHO | B. | CH3COOC2H5 | C. | CH3COOH | D. | CH3CH2OH |
7.下列各组液体只用一种试剂无法鉴别的是( )
| A. | 乙醇、甲苯、硝基苯 | B. | 苯、苯酚、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 苯酚、硫氰化钾溶液、氢氧化钠溶液 |
17.下列离子方程式正确的是( )
| A. | 向盐酸中滴加氨水:H++OH-=H2O | |
| B. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| D. | Na2SO3溶液中加入稀硝酸:SO32-+2H+=SO2↑+H2O |
4. 按要求回答下列各题:
按要求回答下列各题:
(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为
(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
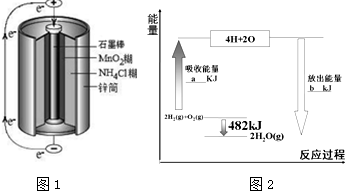
(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
根据图2中能量变化图,回答下列问题:
①图中:a=1370. ②表格中:X=463.
 按要求回答下列各题:
按要求回答下列各题:(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为

(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图
 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |
①图中:a=1370. ②表格中:X=463.
2.下列有关电池的说法不正确的是( )
| A. | 锌锰干电池中,锌电极是负极 | |
| B. | 手机上用的锂离子电池属于二次电池 | |
| C. | 甲烷燃料电池可把化学能转化为电能 | |
| D. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: