题目内容
10.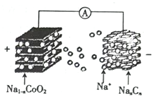 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
| A. | 充电时,Na+向正极移动 | |
| B. | 放电时,负极的电极反应式为NaxCn-xe-=xNa++Cn | |
| C. | 充电时,阴极质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-=Na1-xCoO2+xNa+ |
分析 A、充电时,是电解池的工作原理,电解质里的阳离子移向阴极,电池的负极和电源的负极相连;
B、放电时,是原电池工作原理,负极上发生失电子的氧化反应;
C、充电时,是电解池的工作原理,在阴极上是阳离子发生得电子的还原反应;
D、充电时,是电解池的工作原理,在阳极上发生失电子的氧化反应.
解答 解:A、充电时,是电解池的工作原理,电解质里的阳离子移向阴极,电池的负极和电源的负极相连,即Na+向负极移动,故A错误;
B、放电时,是原电池工作原理,负极上发生失电子的氧化反应,电极反应式为NaxCn-xe-=xNa++Cn,故B正确;
C、充电时,是电解池的工作原理,在阴极上是阳离子发生得电子的还原反应,和负极反应相反,电极质量不会减小,故C错误;
D、充电时,是电解池的工作原理,在阳极上发生失电子的氧化反应NaCoO2-xe-=Na1-xCoO2+xNa+,故D正确.
故选AC.
点评 本题考查原电池和电解池的工作原理以及电极反应式的书写知识,属于综合电化学知识的考查,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.某化学兴趣小组利用如图装罝进行某些物质的制备和性质实验(图中部分夹持装置省略).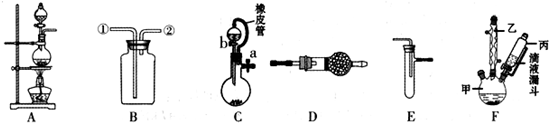
(1)为制取干燥氨气,可将装置C与D连接,C中橡皮管的作用是平衡分液漏斗与圆底烧瓶中压强,便于液体顺利流下;装置D中的固体宜选用碱石灰.
(2)利用装罝A和E组合实验可比较Cl2和I2的氧化性强弱.若E中盛有混合液体,下层是CCl4,充分反应后,振荡E,观察到能证明Cl2和I2氧化性强弱的实验现象是四氯化碳层由无色变为紫红色,其反应的离子方程式为Cl2+2I-=2Cl-+I2.
(3)在装罝B中装满水可用来收集NO,此时NO气体的入口是②(填①或②).
(4)利用装罝F可在实验室中制备对氯苯甲酸( ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
实验步骤:在装置F250mL的三颈烧瓶中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯(6.42g),在温度约93℃时,逐滴滴入对氯甲苯,并控制温度在93℃左右,反应2小时,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,并加入稀硫酸酸化、加热浓缩,再过滤,将滤渣用冷水洗涤,干燥后称量滤渣质量为7.19g.清回答下列问题:
①量取6.OOmL对氯甲苯应选用的仪器是C(填正确选项的编号).
A.10mL量筒 B.50mL容量瓶 C.25mL酸式滴定管 D.25mL碱式滴定管
②控制温度在93℃左右的加热方法是水浴加热.
③将洗涤液与滤液合并后加入稀硫酸酸化时,可观察到的实验现象是产生白色沉淀.
④本实验的产率约为D(填正确选项的编号).
A.60% B.70% C.80% D.90%

(1)为制取干燥氨气,可将装置C与D连接,C中橡皮管的作用是平衡分液漏斗与圆底烧瓶中压强,便于液体顺利流下;装置D中的固体宜选用碱石灰.
(2)利用装罝A和E组合实验可比较Cl2和I2的氧化性强弱.若E中盛有混合液体,下层是CCl4,充分反应后,振荡E,观察到能证明Cl2和I2氧化性强弱的实验现象是四氯化碳层由无色变为紫红色,其反应的离子方程式为Cl2+2I-=2Cl-+I2.
(3)在装罝B中装满水可用来收集NO,此时NO气体的入口是②(填①或②).
(4)利用装罝F可在实验室中制备对氯苯甲酸(
 ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
| 熔点/℃ | 沸点/℃ | 颜色 | 水溶性 | 相对分子质量 | |
| 对氯甲苯 | 7.5 | 162 | 无色 | 难溶 | 126.5 |
| 对氯苯甲酸 | 243 | 275 | 白色 | 微溶 | 156.5 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
①量取6.OOmL对氯甲苯应选用的仪器是C(填正确选项的编号).
A.10mL量筒 B.50mL容量瓶 C.25mL酸式滴定管 D.25mL碱式滴定管
②控制温度在93℃左右的加热方法是水浴加热.
③将洗涤液与滤液合并后加入稀硫酸酸化时,可观察到的实验现象是产生白色沉淀.
④本实验的产率约为D(填正确选项的编号).
A.60% B.70% C.80% D.90%
1.把下列四种X溶液分别加入四个盛有10ml 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2mol/L的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
18.居民使用的管道煤气主要成分是H2、CO和少量CH4、H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如下表:
天然气已经成为城市居民使用的主要生活能源.使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大空气(填“空气”或“天然气”)的进入量或减少天然气(填“空气”或“天然气”)的进入量.1m3(标准状况)甲烷在25℃,101kPa时,充分燃烧生成二氧化碳气体和液态水时释放的热能是3.97×104kJ.
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
19.下列化学反应中,属于氧化还原反应的是( )
| A. | SO3+H2O═H2SO4 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | AgNO3+HCl═AgCl↓+HNO3 |
20.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
| A. | -386kJ•mol-1 | B. | +386kJ•mol-1 | C. | -746kJ•mol-1 | D. | +746kJ•mol-1 |
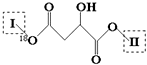 (其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
(其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
 .
. .
.
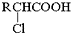 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH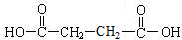 .
.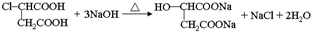 .
.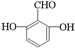 、
、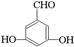 、
、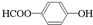 .
. ,B
,B ,C
,C ,D
,D .它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).