题目内容
18.居民使用的管道煤气主要成分是H2、CO和少量CH4、H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如下表:| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
分析 根据化学方程式中的微观粒子个数比进行分析消耗氧气的多少;由于燃烧同样质量的天然气和一氧化碳,天然气燃烧需要的氧气多,燃烧管道煤气的灶具如需改烧天然气,需要加大氧气的量;根据标况下Vm=22.4L/mol,计算1m3的甲烷的物质的量,再利用物质的量与热量的正比例关系来计算.
解答 解:由化学方程式的微观粒子个数比可知,燃烧相同体积的管道煤气和天然气时,天然气消耗的氧气多;燃烧管道煤气的灶具如需改燃天然气,灶具的改进方法是增大进风口;如果燃料不完全燃烧,能生成一氧化碳等污染环境的物质;所以使用管道煤气用户改用天然气,应调整灶具进气量阀门,即增大空气的进入量或减少天然气的进入量;标况下Vm=22.4L/mol,则1m3的甲烷的物质的量$\frac{1000L}{22.4L/mol}$=44.64mol,由25℃,101kPa时,1molCH4充分燃烧放出的热量为890kJ,则1m3(标况)甲烷在25℃,101kPa时充分燃烧,可以放出的热能是44.64×890KJ=3.97×104kJ,
故答案为:空气;天然气;3.97×104.
点评 本题考查了反应热的计算,侧重于考查学生的分析能力和计算能力,注意把握燃烧热的概念,题目难度中等.

练习册系列答案
相关题目
8. 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不退色.
(2)盐酸的物质的量浓度为0.10mol/L
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是偏高(填“偏高”或“偏低”或“无影响”,下同).
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在甲中(填“甲”或“乙”),该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
(2)盐酸的物质的量浓度为0.10mol/L
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是偏高(填“偏高”或“偏低”或“无影响”,下同).
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在甲中(填“甲”或“乙”),该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
10.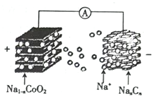 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
| A. | 充电时,Na+向正极移动 | |
| B. | 放电时,负极的电极反应式为NaxCn-xe-=xNa++Cn | |
| C. | 充电时,阴极质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-=Na1-xCoO2+xNa+ |
7.下列说法正确的是( )
| A. | PCl5 分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移 | |
| B. | 两个原子间形成共价键时,最多可以有两个σ键 | |
| C. | H3O+中H-O-H的键角比H2O中H-O-H的键角大 | |
| D. | 酸性强弱比较:HClO>HClO2 |
8.在电解池中,阴极上发生的反应是( )
| A. | 还原反应 | B. | 氧化反应 | C. | 失去电子被氧化 | D. | 得到电子被氧化 |