题目内容
20.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
| A. | -386kJ•mol-1 | B. | +386kJ•mol-1 | C. | -746kJ•mol-1 | D. | +746kJ•mol-1 |
分析 依据盖斯定律内容和含义,结合热化学方程式计算得到所需热化学方程式得到.
解答 解:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
依据盖斯定律计算①-②得到2CO(g)+2NO(g)═N2(g)+2CO2(g))△H=-746KJ/mol;
故选C.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,掌握基础知识是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.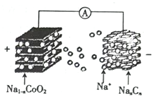 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
| A. | 充电时,Na+向正极移动 | |
| B. | 放电时,负极的电极反应式为NaxCn-xe-=xNa++Cn | |
| C. | 充电时,阴极质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-=Na1-xCoO2+xNa+ |
8.在电解池中,阴极上发生的反应是( )
| A. | 还原反应 | B. | 氧化反应 | C. | 失去电子被氧化 | D. | 得到电子被氧化 |
15.下列说法正确的是( )
| A. | 乙烯和甲苯都能使酸性KMnO4溶液褪色 | |
| B. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃 | |
| C. | CH2=CH2和CH3CH2Cl都属于烃 | |
| D. | C2H4和C4H8一定都能使溴水褪色 |
12.下列关于碱金属的说法不正确的是( )
| A. | 实验室少量金属钠保存在煤油中 | |
| B. | 从锂到铯,金属性逐渐减弱 | |
| C. | 金属钠与水反应时放出氢气 | |
| D. | 从锂到铯,单质与水反应越来越剧烈 |
9.现有部分短周期元素的性质或原子结构如下表:
(1)元素X位于元素周期表的第二周期第IVA族,它的一种核素可测定文物年代,这种核素的符号是146C.
(2)元素Y的原子结构示意图为 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应.
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y的原子结构示意图为
 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取少量样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应.
10.三氟化氮(NF3,无色气体,其中F为-1价)是微电子工业中一种优良的等离子蚀刻气体.在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关判断正确的是( )
| A. | 反应中NF3是氧化剂,H2O是还原剂 | |
| B. | NF3在潮湿空气中泄漏会产生无色气体 | |
| C. | 反应中还原剂与氧化剂的物质的量之比为1:2 | |
| D. | 若反应中生成0.1 mol HNO3,则反应共转移0.1 mol电子 |
 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: