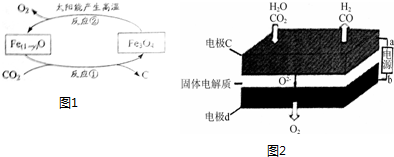
题目内容
1.把下列四种X溶液分别加入四个盛有10ml 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2mol/L的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
分析 计算出稀释后X溶液的中X的物质的量,最后溶液的体积都为50mL,则X的物质的量越大,X的浓度越大,而浓度越大、温度越高,反应速率越快.
解答 解:A.20mL3mol/L的X溶液,X的物质的量为0.02L×3mol/L=0.06mol;
B.30mL2mol/L的X溶液,X的物质的量为0.03L×2mol/L=0.06mol;
C.10mL4mol/L的X溶液,X的物质的量为0.01L×4mol/L=0.04mol;
D.10mL2mol/L的X溶液,X的物质的量为0.01L×2mol/L=0.02mol,
显然四种情况下,X浓度A=B>C>D,而温度B=C>A=D,故反应速率B的反应速率最快,
故选B.
点评 本题考查化学反应速率影响因素,涉及温度、浓度对反应速率的影响,注意利用控制变量法进行分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.已知氮原子的质量数为14,则在NH3D1中,电子数、质子数、中子数之比为( )
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
12.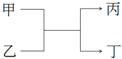 甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
 甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )| A. | H2和Na | B. | S和O2 | C. | C和Si | D. | Cl2和Br2 |
16.下列关于化学用语的表述正确的是( )
| A. | HClO的结构式:H-O-Cl | B. | 纯碱的化学式为:Na2CO3 | ||
| C. | 原子核内有8个中子的碳原子148C | D. | Na2O2电子式为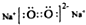 |
10.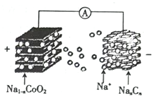 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
| A. | 充电时,Na+向正极移动 | |
| B. | 放电时,负极的电极反应式为NaxCn-xe-=xNa++Cn | |
| C. | 充电时,阴极质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-=Na1-xCoO2+xNa+ |