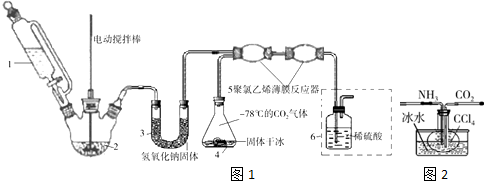
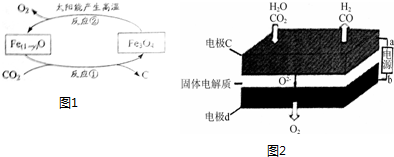
题目内容
15.A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半.请回答下列问题:(1)4种元素的符号依次是AS,BCl,CK,DCa.它们的原子半径由大到小的顺序是K>Ca>S>Cl.
(2)试写出4种元素的离子结构示意图:A
 ,B
,B ,C
,C ,D
,D .它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).(3)它们最高价氧化物对应水化物的化学式分别是H2SO4、HClO4、KOH、Ca(OH)2,分别比较它们酸性和碱性的强弱酸性:HClO4>H2SO4,碱性:KOH>Ca(OH)2.
(4)写出能够生成的气态氢化物的化学式:HCl、H2S,比较其稳定性:HCl,理由是氯元素的非金属性强于硫元素.
分析 A、B、C、D 4种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K,据此解答.
解答 解:A、B、C、D 4种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K.
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:K>Ca>S>Cl,
故答案为:S;Cl;K;Ca;K>Ca>S>Cl;
(2)S2-离子结构示意图为 ,Cl-离子结构示意图为
,Cl-离子结构示意图为 ,K+离子结构示意图为
,K+离子结构示意图为 ,Ca2+离子结构示意图为
,Ca2+离子结构示意图为 ,
,
电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),
故答案为: ;
; ;
; ;
; ;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
(3)A、B、C、D 4种元素的最高价氧化物对应水化物的化学式分别是H2SO4、HClO4、KOH、Ca(OH)2,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:KOH>Ca(OH)2,
故答案为:H2SO4、HClO4、KOH、Ca(OH)2;酸性:HClO4>H2SO4,碱性:KOH>Ca(OH)2;
(4)生成的气体氢化物有HCl、H2S,氯元素的非金属性强于硫元素,故氢化物稳定性HCl>H2S,
故答案为:HCl、H2S;HCl;氯元素的非金属性强于硫元素.
点评 本题考查结构性质位置关系应用,充分根据核外电子排布推断A、D,侧重对元素周期律与化学用语的考查,注意对基础知识的理解掌握.

 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:NaCoO2+Cn$?_{放电}^{充电}$Na2-xCoO2+NaxCn
其电池结构如图所示.下列说法不正确的是( )
| A. | 充电时,Na+向正极移动 | |
| B. | 放电时,负极的电极反应式为NaxCn-xe-=xNa++Cn | |
| C. | 充电时,阴极质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-=Na1-xCoO2+xNa+ |
| A. | m=1,n=5 | B. | m=4,n=3 | C. | m=3,n=4 | D. | m=4,n=5 |
| A. | PCl5 分子中所有原子都满足最外层8电子稳定结构且共用电子对发生偏移 | |
| B. | 两个原子间形成共价键时,最多可以有两个σ键 | |
| C. | H3O+中H-O-H的键角比H2O中H-O-H的键角大 | |
| D. | 酸性强弱比较:HClO>HClO2 |
| A. | 氧的五种同位素 | B. | 五种氧元素 | ||
| C. | 氧的五种同素异形体 | D. | 氧元素的五种不同微粒 |
 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示: