题目内容
X为Fe2O3和CuO的固体混合物,取两份质量相等的X样品进行如图所示实验.已知从③步所得固体D的质量为12.8g,无色气体E在标准状况下的体积为2.24L.请回答: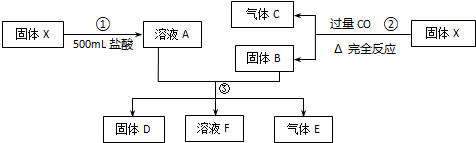
(1)写出步骤①的任意一个反应的离子方程式 .
(2)用什么简单方法检验固体D是纯净物还是混合物? .
(3)若固体D是纯净物,则:
①每份X样品中Fe2O3的质量为 .
②忽略溶液的体积变化,则溶液F中Cl-的物质的量浓度至少为 .

(1)写出步骤①的任意一个反应的离子方程式
(2)用什么简单方法检验固体D是纯净物还是混合物?
(3)若固体D是纯净物,则:
①每份X样品中Fe2O3的质量为
②忽略溶液的体积变化,则溶液F中Cl-的物质的量浓度至少为
考点:有关混合物反应的计算
专题:计算题
分析:(1)Fe2O3和CuO都是碱性氧化物,都能够与盐酸反应生成盐和水,据此写出反应的离子方程式;
(2)X与过量CO反应生成固体B为铁和铜的混合物,溶液A中含有氯化铁、氯化铜,则D可能为铜,有可能为铁与铜的混合物,根据铁与铜的性质选择检验方法;
(3)①根据溶液中离子氧化性Fe3+>Cu2+>H+可知,如果D为纯净物,则D只能为铜,气体E为氢气,溶液F中含有氯化亚铁,有可能还含有剩余的氯化氢,设出氧化铁的物质的量,然后根据反应应Fe+2H+═Fe2++H2↑、Cu2++Fe═Fe2++Cu、2Fe3++Fe═3Fe2+及题中数据列式计算出氧化铁的物质的量、质量;
②溶液F中含有氯化亚铁,可能含有氯化氢,根据铁元素守恒计算出氯离子至少的物质的量,然后根据c=
计算出氯离子的物质的量浓度.
(2)X与过量CO反应生成固体B为铁和铜的混合物,溶液A中含有氯化铁、氯化铜,则D可能为铜,有可能为铁与铜的混合物,根据铁与铜的性质选择检验方法;
(3)①根据溶液中离子氧化性Fe3+>Cu2+>H+可知,如果D为纯净物,则D只能为铜,气体E为氢气,溶液F中含有氯化亚铁,有可能还含有剩余的氯化氢,设出氧化铁的物质的量,然后根据反应应Fe+2H+═Fe2++H2↑、Cu2++Fe═Fe2++Cu、2Fe3++Fe═3Fe2+及题中数据列式计算出氧化铁的物质的量、质量;
②溶液F中含有氯化亚铁,可能含有氯化氢,根据铁元素守恒计算出氯离子至少的物质的量,然后根据c=
| n |
| V |
解答:
解:(1)Fe2O3和CuO都能够与盐酸反应,反应的离子方程式分别为:Fe2O3+6H+=2Fe3++3H2O、CuO+2H+=Cu2++H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O(或CuO+2H+=Cu2++H2O);
(2)根据题中转化关系可知,D可能为铜,有可能为铁和铜的混合物,利用磁铁进行检验,方法为:干燥后用磁铁吸引,若有固体被吸起,则证明是混合物,否则为纯净物,
故答案为:干燥后用磁铁吸引,若有固体被吸起,则证明是混合物,否则为纯净物;
(3)①固体D为纯净物时,由于还原性Fe>Cu,则D为Cu,铁完全反应,铜的物质的量为:n(Cu)=
=0.2mol,铁置换出的铜为:0.2mol×
=0.1mol,即每份样品中都含有0.1mol氧化铜,
气体E为氢气,标况下2.24L氢气的物质的量为:
=0.1mol,溶液中离子氧化性:Fe3+>Cu2+>H+,反应生成了氢气,则溶液F为氯化亚铁,设样品中氧化铁的物质的量为x,则固体B中含有2xmol铁、溶液A中含有2xmol铁离子,根据反应Fe+2H+═Fe2++H2↑、Cu2++Fe═Fe2++Cu、2Fe3++Fe═3Fe2+可知:x+0.1mol+0.1mol=2x,解得:x=0.2mol,则氧化铁的质量为:160g/mol×0.2mol=3.2g,
故答案为:32g;
②溶液F为氯化亚铁溶液,有可能含有剩余的氯化氢,根据铁元素守恒,溶液F中含有氯化亚铁的物质的量为:0.2mol×2×2=0.8mol,含有氯离子至少为:0.8mol×2=1.6mol,则Cl-的物质的量浓度至少为:
=3.2mol/L,
故答案为:3.2 mol/L.
故答案为:Fe2O3+6H+=2Fe3++3H2O(或CuO+2H+=Cu2++H2O);
(2)根据题中转化关系可知,D可能为铜,有可能为铁和铜的混合物,利用磁铁进行检验,方法为:干燥后用磁铁吸引,若有固体被吸起,则证明是混合物,否则为纯净物,
故答案为:干燥后用磁铁吸引,若有固体被吸起,则证明是混合物,否则为纯净物;
(3)①固体D为纯净物时,由于还原性Fe>Cu,则D为Cu,铁完全反应,铜的物质的量为:n(Cu)=
| 12.8g |
| 64g/mol |
| 1 |
| 2 |
气体E为氢气,标况下2.24L氢气的物质的量为:
| 2.24L |
| 22.4L/mol |
故答案为:32g;
②溶液F为氯化亚铁溶液,有可能含有剩余的氯化氢,根据铁元素守恒,溶液F中含有氯化亚铁的物质的量为:0.2mol×2×2=0.8mol,含有氯离子至少为:0.8mol×2=1.6mol,则Cl-的物质的量浓度至少为:
| 1.6mol |
| 0.5L |
故答案为:3.2 mol/L.
点评:本题考查了有关混合物的计算、常见金属单质及其化合物的性质,题目难度较大,正确分析反应流程及题干信息为解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为NA |
| B、通常状况下,NA个CO2分子占有的体积为22.4L |
| C、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
| D、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
为了提高SO2的转化率,通常通入过量的空气,使SO2充分和O2反应,则从接触室导出的混合气体含有( )
| A、SO3、O2 |
| B、SO3、O2、N2 |
| C、SO3、SO2、O2、N2 |
| D、SO3、N2 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A、未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B、因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C、铁制品应该连接在直流电源的负极 |
| D、镀锌层破损后即对铁制品失去保护作用 |
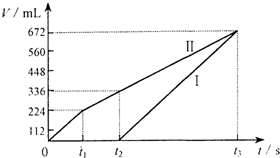 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息(Ⅰ、Ⅱ两极分别代表两极各自产生的气体体积),通过计算推测: