题目内容
研究铜及其化合物具有十分重要意义.
(1)Cu2S能与硝酸反应.与稀硝酸反应的化学方程式为3Cu2S+16HNO3═3Cu(NO3)2+3CuSO4+10NO+8H2O
反应中的还原剂是 ,当有160gCu2S反应时.转移的电子总数为 .
(2)铜不溶于稀硫酸.可溶于铁盐溶液,现将一定量的铜加入到200mL稀硫酸和硫酸铁的混合溶液中.铜溶解:
①铜溶于铁盐的离子方程式为 .
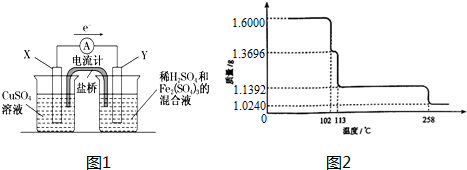
②某同学将该反应设计成如图装置.Y极的电极反应式为 .盐桥中阴离子移向 溶液.
(3)纳米Cu2O是一种用途广泛的光电材料.以铜为电极,以氢氧化钠溶液为电解质溶液进行电解可制得Cu2O,阳极的电极反应式为 .
(4)1.6000g CuSO4?5H2O晶体加热受热分解过程的样品质量随温度变化曲线如图2所示,270℃固体物质的化学式为 ,将0.1mol CuSO4?5H2O配成100mL溶液,用惰性电极电解,当电解过程中转移0.3mol电子时,加入下列物质能恢复至原来浓度和pH的物质是(填序号) .
a、CuO b、Cu(OH)4 c、CuSO4 d、Cu2(OH)2CO3
(1)Cu2S能与硝酸反应.与稀硝酸反应的化学方程式为3Cu2S+16HNO3═3Cu(NO3)2+3CuSO4+10NO+8H2O
反应中的还原剂是
(2)铜不溶于稀硫酸.可溶于铁盐溶液,现将一定量的铜加入到200mL稀硫酸和硫酸铁的混合溶液中.铜溶解:
①铜溶于铁盐的离子方程式为
②某同学将该反应设计成如图装置.Y极的电极反应式为
(3)纳米Cu2O是一种用途广泛的光电材料.以铜为电极,以氢氧化钠溶液为电解质溶液进行电解可制得Cu2O,阳极的电极反应式为
(4)1.6000g CuSO4?5H2O晶体加热受热分解过程的样品质量随温度变化曲线如图2所示,270℃固体物质的化学式为
a、CuO b、Cu(OH)4 c、CuSO4 d、Cu2(OH)2CO3

考点:铜金属及其重要化合物的主要性质,原电池和电解池的工作原理
专题:元素及其化合物
分析:(1)依据化学方程式中 元素化合价变化分析,元素化合价升高的失电子发生氧化反应,做还原剂,依据n=
计算物质的量结合元素化合价变化计算反应的电子转移;
(2)若欲在如图所示的装置中发生铜溶于铁盐的反应,依据电子流向,X做负极失电子发生氧化反应,铜电极是负极,不如铜活泼的金属或导电的非金属作正极,Y为负极,溶液中铁离子得到电子发生还原反应;依据电解质溶液中电荷守恒分析盐桥中阴离子移向方向;
(3)以铜为电极,以氢氧化钠溶液为电解质溶液进行电解可制得Cu2O,阳极铜失电子在碱溶液中中生成氧化亚铜,结合电荷守恒书写电极反应;
(4)由图分析可知,CuSO4?5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在258℃时失去的水的质量为1.600g-1.0240g=0.576g,根据相应的化学方程式即可确定此时固体物质的化学式;依据电解原理和电极反应分析判断生成产物,结合电子守恒计算,根据出什么加什么的原则判断加入物质恢复原浓度;
| m |
| M |
(2)若欲在如图所示的装置中发生铜溶于铁盐的反应,依据电子流向,X做负极失电子发生氧化反应,铜电极是负极,不如铜活泼的金属或导电的非金属作正极,Y为负极,溶液中铁离子得到电子发生还原反应;依据电解质溶液中电荷守恒分析盐桥中阴离子移向方向;
(3)以铜为电极,以氢氧化钠溶液为电解质溶液进行电解可制得Cu2O,阳极铜失电子在碱溶液中中生成氧化亚铜,结合电荷守恒书写电极反应;
(4)由图分析可知,CuSO4?5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在258℃时失去的水的质量为1.600g-1.0240g=0.576g,根据相应的化学方程式即可确定此时固体物质的化学式;依据电解原理和电极反应分析判断生成产物,结合电子守恒计算,根据出什么加什么的原则判断加入物质恢复原浓度;
解答:
解:(1)3Cu2S+16HNO3═3Cu(NO3)2+3CuSO4+10NO+8H2O,反应中铜元素化合价+1价变化为+2价,硫元素化合价-2价变化为+6价,硝酸中氮元素化合价+5价变化为+2价,所以Cu2S在反应中做还原剂,每3molCu2S反应电子转移30mol,160gCu2S物质的量=
=1mol,则1molCu2S反应电子转移10mol,电子数为6.02×1024 ;
故答案为:Cu2S,6.02×1024 ;
(2)①铜溶于铁盐是亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
②若欲在如图所示的装置中发生铜溶于铁盐的反应,依据电子流向,X做负极失电子发生氧化反应,铜电极是负极,不如铜活泼的金属或导电的非金属作正极,Y为负极,溶液中铁离子得到电子发生还原反应,电极反应为;Fe3++e-=Fe2+,依据电解质溶液中电荷守恒分析,铜电极生成铜离子进入溶液中,盐桥中阴离子移向硫酸铜溶液;
故答案为:Fe3++e-=Fe2+,硫酸铜;
(3)纳米Cu2O是一种用途广泛的光电材料.以铜为电极,以氢氧化钠溶液为电解质溶液进行电解可制得Cu2O,阳极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O;
故答案为:2Cu+2OH--2e-=Cu2O+H2O;
(4)CuSO4?5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4?5H2O
CuSO4?(5-n)H2O+nH2O
250 18n
1.60g 1.60g-1.024g=0.576g
解得n=5,
270℃时该固体物质的化学式为CuSO4,
故答案为CuSO4;
将0.1mol CuSO4?5H2O配成100mL溶液,溶液中铜离子物质的量0.1mol,用惰性电极电解,当电解过程中转移0.3mol电子时,
阳极电极反应:4OH--4e-=2H2O+O2↑
0.3mol 0.3mol
阴极电极反应:Cu2++2e-=Cu
0.1mol 0.2mol
2H++2e-=H2↑
0.1mol 0.1mol
电解过程为电解电解质为0.1mol硫酸铜溶液,电解0.,05mol水,铜硫酸铜和水物质的量之比为2:1,加入CuO,水不足,加入Cu(OH)2,硫酸铜物质的量和水之比为1:2,不符合,加入硫酸铜只能恢复溶质,电解的水不能恢复,加入Cu2(OH)2CO3 ,加入的硫酸铜和水物质的量为2:1,能恢复原溶液浓度;
加入下列物质能恢复至原来浓度和pH的物质为Cu2(OH)2CO3 ;
故答案为:d;
| 160g |
| 160g/mol |
故答案为:Cu2S,6.02×1024 ;
(2)①铜溶于铁盐是亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
②若欲在如图所示的装置中发生铜溶于铁盐的反应,依据电子流向,X做负极失电子发生氧化反应,铜电极是负极,不如铜活泼的金属或导电的非金属作正极,Y为负极,溶液中铁离子得到电子发生还原反应,电极反应为;Fe3++e-=Fe2+,依据电解质溶液中电荷守恒分析,铜电极生成铜离子进入溶液中,盐桥中阴离子移向硫酸铜溶液;
故答案为:Fe3++e-=Fe2+,硫酸铜;
(3)纳米Cu2O是一种用途广泛的光电材料.以铜为电极,以氢氧化钠溶液为电解质溶液进行电解可制得Cu2O,阳极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O;
故答案为:2Cu+2OH--2e-=Cu2O+H2O;
(4)CuSO4?5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4?5H2O
| ||
250 18n
1.60g 1.60g-1.024g=0.576g
解得n=5,
270℃时该固体物质的化学式为CuSO4,
故答案为CuSO4;
将0.1mol CuSO4?5H2O配成100mL溶液,溶液中铜离子物质的量0.1mol,用惰性电极电解,当电解过程中转移0.3mol电子时,
阳极电极反应:4OH--4e-=2H2O+O2↑
0.3mol 0.3mol
阴极电极反应:Cu2++2e-=Cu
0.1mol 0.2mol
2H++2e-=H2↑
0.1mol 0.1mol
电解过程为电解电解质为0.1mol硫酸铜溶液,电解0.,05mol水,铜硫酸铜和水物质的量之比为2:1,加入CuO,水不足,加入Cu(OH)2,硫酸铜物质的量和水之比为1:2,不符合,加入硫酸铜只能恢复溶质,电解的水不能恢复,加入Cu2(OH)2CO3 ,加入的硫酸铜和水物质的量为2:1,能恢复原溶液浓度;
加入下列物质能恢复至原来浓度和pH的物质为Cu2(OH)2CO3 ;
故答案为:d;
点评:本题考查了铜及其化合物性质的分析判断,电解原理的分析应用,主要是原电池、电解池原理分析计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
A2、B2、C23种单质和它们离子间能发生下列反应:①2A-+C2═2C-+A2 ②2C-+B2═2B-+C2,则有关说法中不正确的是( )
| A、氧化性:B2>C2>A2 |
| B、在含有C-和A-的溶液中加入B2,C-优先发生反应 |
| C、还原性:B->C->A- |
| D、在含有B2和C2的溶液中加入A-,B2优先发生反应 |
下列表述正确的是( )
A、H2O2的电子式: | ||
B、Cl的原子结构示意图: | ||
C、质子数是82,中子数是122的铅原子:
| ||
D、CO2的比例模型: |
下列关于胶体的说法中正确的是( )
| A、胶体外观不均匀 |
| B、胶体不能通过滤纸 |
| C、胶体粒子不停地无秩序运动 |
| D、胶体不稳定,静止后容易形成沉淀 |
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、硫酸、纯碱、食盐 |
| B、磷酸、熟石灰、苛性钠 |
| C、碳酸、乙醇、醋酸钠 |
| D、盐酸、烧碱、胆矾 |
 已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则:
已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.则: