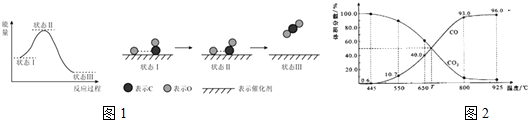
题目内容
3.含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.(1)红酒中添加一定量的SO2可以防止酒液氧化.这应用了SO2的还原性.
(2)某水体中硫元素主要以S2O32-形式存在.在酸性条件下,该离子会导致水体中亚硫酸的浓度增大,原因是在酸性条件下2H++S2O32-=SO2↓+S↓+H2O,SO2+H2O=H2SO3,导致溶液中酸性增强.
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
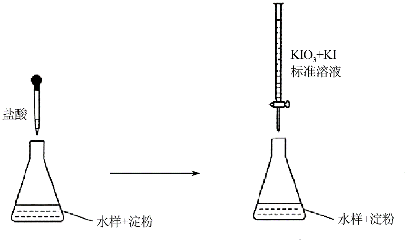
①滴定时,KIO3 和KI 作用析出I2,完成并配平下列离子方程式:
1IO${\;}_{3}^{-}$+5I-+6H+=3I2+3H2O
②反应①所得I2的作用是氧化亚硫酸根离子和硫代硫酸根离子.
③滴定终点时,100mL的水样共消耗xmL标准溶液.若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中
SO32-的含量为104xmg/L.
(4)微生物燃烧电池是指在微生物的作用下将化学能转化为电能的装置.某微生物燃料电池的工作原理如图所示:
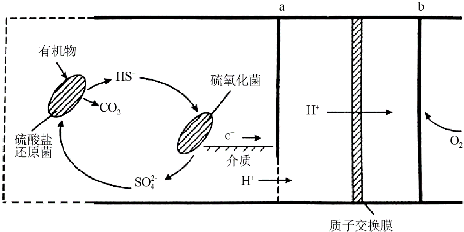
①HS-在硫氧化菌作用下转化为SO42-的反应式是HS-+4H2O-8e-=SO42-+9H+.
②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是两种细菌存在,就会循环把有机物氧化成CO2放出电子,使电池则可以持续供电.
分析 (1)二氧化硫具有还原性,可以抗氧化;
(2)酸性条件下S2O32-发生自身的氧化还原反应,生成二氧化硫,二氧化硫与水反应生成亚硫酸;
(3)①酸性条件下,KIO3溶液与KI溶液发生反应生成I2;
②反应①所得I2的作用是氧化亚硫酸根离子和硫代硫酸根离子;
③100mL的水样共消耗xmL标准溶液.若消耗1mL标准溶液相当于SO32-的质量1g,所以100mL中含有xgSO32-,所以1L该水样中SO32-的含量为104xmg/L;
(4)①HS-在硫氧化菌作用下转化为SO42-,失电子发生氧化反应,电极反应式是HS-+4H2O-8e-=SO42-+9H+;
②由图可知硫酸盐还原菌可以将有机物氧化成二氧化碳,而硫氧化菌可以将硫氢根离子氧化成硫酸根离子,所以两种细菌存在,就会循环把有机物氧化成CO2 放出电子.
解答 解:(1)SO2可以防止酒液氧化.这应用了SO2的还原性,故答案为:还原性;
(2)酸性条件下S2O32-发生自身的氧化还原反应,生成二氧化硫,二氧化硫与水反应生成亚硫酸,使水体中亚硫酸浓度增大,故答案为:在酸性条件下2H++S2O32-=SO2↓+S↓+H2O,SO2+H2O=H2SO3,导致溶液中酸性增强;
(3)①酸性条件下,KIO3溶液与KI溶液发生反应生成I2,离子方程式为:IO3-+5I-+6H+=3I2+3H2O,故答案为:1、5、6、H+、3、3;
②反应①所得I2的作用是氧化亚硫酸根离子和硫代硫酸根离子,故答案为:氧化亚硫酸根离子和硫代硫酸根离子;
③100mL的水样共消耗xmL标准溶液.若消耗1mL标准溶液相当于SO32-的质量1g,所以100mL中含有xgSO32-,所以1L该水样中SO32-的含量为104xmg/L,故答案为:104x;(4)①HS-在硫氧化菌作用下转化为SO42-,失电子发生氧化反应,电极反应式是HS-+4H2O-8e-=SO42-+9H+,故答案为:HS-+4H2O-8e-=SO42-+9H+;②由图可知硫酸盐还原菌可以将有机物氧化成二氧化碳,而硫氧化菌可以将硫氢根离子氧化成硫酸根离子,所以两种细菌存在,就会循环把有机物氧化成CO2 放出电子,使电池则可以持续供电,故答案为:两种细菌存在,就会循环把有机物氧化成CO2 放出电子,使电池则可以持续供电.
点评 本题考查元素化合物相关计算问题、氧化还原滴定以及电化学的相关知识,综合性强,有一定的难度.

 寒假学与练系列答案
寒假学与练系列答案| A. | 该反应中旧键断裂吸收的总能量大于新键形成放出的总能量 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应为放热反应 | |
| D. | 该反应的化学能可以转化为电能 |
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
| A. | 苯与溴能发生取代反应,因此不能用苯萃取溴水中的溴 | |
| B. | 相同质量的苯和立方烷(C${\;}_{{8}_{\;}}$H8)完全燃烧,耗氧量一样多 | |
| C. | 乙烯和聚乙烯都能发生加成反应 | |
| D. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 |
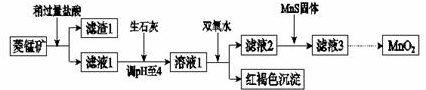
已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度,有利于Mn2+放电(不利于Cl-放电).
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质;
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,分析表中数据可以说明HA是弱电解质;
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大 b.稀盐酸中水的电离程度大 c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
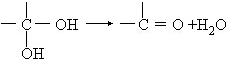
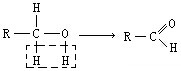
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)