题目内容
18.已知有机物分子中同一碳原子上连接两个羟基是不稳定的,会自动脱水: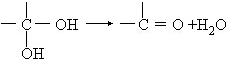
醇的催化氧化是醇的一个重要化学性质.请回答下列问题:
(1)写出乙醇在铜或银催化下受热和氧气反应的化学方程式:2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$2CH3CHO+2H2O;
(2)有人提出了醇催化氧化的两种可能过程:
①去氢氧化:
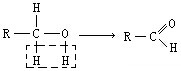
②加氧氧化:
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)
分析 (1)乙醇的催化氧化反应生成乙醛和水;
(2)醇催化氧化的两种可能过程是去氢氧化为乙醛,也可以是加氧氧化,形成一个碳原子上连两个羟基,产物不稳定失水生成乙醛
解答 解:(1)乙醇的催化氧化反应生成乙醛和水,反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$2CH3CHO+2H2O;
(2)醇催化氧化的两种可能过程是去氢氧化为乙醛,也可以是加氧氧化,形成一个碳原子上连两个羟基,产物不稳定失水生成乙醛,
所以加氧氧化的中间产物结构式为: ,
,
故答案为: .
.
点评 本题考查有机物结构和性质,为高频考点,明确醇催化氧化原理是解本题关键,注意反应中断键和成键方式,注意:两个羟基在同一个碳原子上时该物质不稳定.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
9.原子序数为Z的主族元素R,在周期表中位于A、B、C、D四种主族元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是( )
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
6.Fe3+和I-在水溶液中反应如下:2I-+2Fe3+?2Fe2++I2(水溶液).
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,化学反应速率减慢(填“增大”“减慢”或“不变”),v(正)>v(逆)填“>”“<”或“=”).
(2)该反应的正反应速率和Fe3+、I-的浓度关系为v=kcm(I-)•cn(Fe3+)(k为常数).
通过所给的数据计算得知:在v=kcm(I-)•cn (Fe3+)中,m、n的值为C
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
I-浓度对反应速率的影响大于(填“>”“<”或“=”)Fe3+浓度对反应速率的影响.
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,化学反应速率减慢(填“增大”“减慢”或“不变”),v(正)>v(逆)填“>”“<”或“=”).
(2)该反应的正反应速率和Fe3+、I-的浓度关系为v=kcm(I-)•cn(Fe3+)(k为常数).
| c(I-)/mol•L-1 | c(Fe3+)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
I-浓度对反应速率的影响大于(填“>”“<”或“=”)Fe3+浓度对反应速率的影响.
13.25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )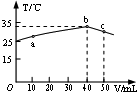

| A. | HA溶液的物质的量浓度为0.01mol/L | |
| B. | a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-3 |
3.下列说法正确的是( )
| A. | 漂白粉密封保存,因为潮湿条件下易于CO2反应 | |
| B. | 光导纤维是将太阳能直接转化为电能的常见材料 | |
| C. | 用氢氟酸蚀刻玻璃和用FeCl3溶液蚀刻铜值线路板,均属于氧化还原反应 | |
| D. | 家用消毒柜中通过高压放电使空气产生少量臭氧,这一过程属于物理变化 |
4.下列说法正确的是( )
| A. | 煤是无机化合物,天然气和石油是有机化合物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,并伴随能量的转化 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |