题目内容
11.碳的氧化物会对环境造成影响,但同时碳的单质、化合物又是重要的化工原料,是化学学科的重要研究对象.(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(l)△H1=-128.5kJ•mol-1
已知:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283kJ•mol-1;
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ•mol-1;
则用热化学方程式表示甲醇的燃烧热应为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.1 kJ•mol-1.
(2)科学家用X射线激光技术观察到了CO与O在催化剂表面形成化学键的过程.反应过程的示意图如图1:
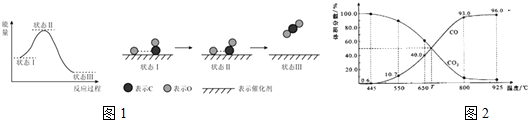
①CO和O生成CO2是放热反应;反应过程中,在催化剂作用下O与CO中的C逐渐靠近,最终形成的化学键类型属于极性键(或共价键).
②结合已有知识和该反应过程,我们该如何理解,化学反应本质中的“分子破裂成为原子”这一观点?参加反应的分子中,可能是部分分子破裂成为原子.
(3)一定量的CO2与足量的C在体积可变的恒压密闭容器中反应::C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图2所示:
①550℃时的V逆小于(填“大于”、“小于”或“等于”)925℃时的V逆,T℃时,若向平衡体系内充入惰性气体,化学平衡将正向移动(填“正向移动”、“逆向移动”或“不移动”).某同学是如何从图中数据,分析出该反应的正反应是吸热反应的?温度越高时,产物CO的体积分数越大.
②650℃时,反应达平衡后CO2的转化率为25%.
③若反应时的压强为akPa,已知气体分压(P分)=气体总压(P总)×体积分数,800时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=12.4akPa.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;根据盖斯定律和题中热化学方程式写出甲醇完全燃烧生成二氧化碳和液态水的热化学方程式;(2)①由图可知反应物总能量大于生成物总能量,为放热反应;不同非金属元素之间形成的化学键为极性共价键;
②化学反应的本质为原子的重新组合,结合图象分析;
(3)①图象分析可知:925℃时的CO的体积分数高,反应速率快,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,升温一氧化碳浓度增大,二氧化碳浓度减小,平衡正向进行,正反应为吸热反应;
②由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
③用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{{P}^{2}(CO)}{P(C{O}_{2})}$,据此计算.
解答 解:(1)根据反应①CO(g)+2H2(g)?CH3OH(l)△H1=-128.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283kJ•mol-1;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ•mol-1;
根据盖斯定律:-①+②+③×2得:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.1kJ•mol-1,
故答案是:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.1 kJ•mol-1;
(2)①由图可知反应物总能量大于生成物总能量,为放热反应,CO与O在催化剂表面形成CO2,CO2含有极性共价键,
故答案为:放;极性键(或共价键);
②CO与O在催化剂表面形成CO2,所以状态Ⅰ→状态Ⅲ表示CO与O反应的过程,说明参加反应的分子中,可能是部分分子破裂成为原子,
故答案为:参加反应的分子中,可能是部分分子破裂成为原子;
(3)①图象分析可知:550℃时CO的体积分数为10.7%,925℃时的CO的体积分数96%,显然,925℃时CO的浓度大,反应速率快,所以550℃时的V逆小于925℃时的V逆,
T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,此点后,化学反应随升高温度一氧化碳浓度增大,二氧化碳浓度减小,平衡正向进行,升温平衡向吸热反应反应进行,所以正反应为吸热反应,
故答案为:小于;向正反应方向;温度越高时,产物CO的体积分数越大;
②由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为$\frac{0.25}{1}$×100%=25%,
故答案为:25.0%;
③800℃时,CO的体积分数为93%,则CO2的体积分数为7%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{{P}^{2}(CO)}{P(C{O}_{2})}$=$\frac{(0.93KP)^{2}}{0.07kp}$≈12.4akPa,
故答案为:12.4akPa.
点评 本题考查了化学平衡图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | c(OH-)>c(Na+)+c(H+) | |
| B. | 由水电离出的c(OH-)=1.0×10-2mol﹒L-1 | |
| C. | 与等体积pH=2的醋酸混合后所得溶液显碱性 | |
| D. | 与等体积0.01mol﹒L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(Cl-) |
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,化学反应速率减慢(填“增大”“减慢”或“不变”),v(正)>v(逆)填“>”“<”或“=”).
(2)该反应的正反应速率和Fe3+、I-的浓度关系为v=kcm(I-)•cn(Fe3+)(k为常数).
| c(I-)/mol•L-1 | c(Fe3+)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
I-浓度对反应速率的影响大于(填“>”“<”或“=”)Fe3+浓度对反应速率的影响.
| A. | 漂白粉密封保存,因为潮湿条件下易于CO2反应 | |
| B. | 光导纤维是将太阳能直接转化为电能的常见材料 | |
| C. | 用氢氟酸蚀刻玻璃和用FeCl3溶液蚀刻铜值线路板,均属于氧化还原反应 | |
| D. | 家用消毒柜中通过高压放电使空气产生少量臭氧,这一过程属于物理变化 |
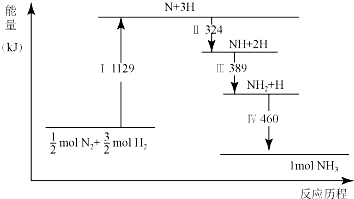
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅳ中NH2与H2生成NH3 | ||
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | D. | N2(g)+3H2(g)?2NH3(g)△H>0 |