题目内容
5.重水(${\;}_{1}^{2}$H2O)是重要的核工业原料,关于氘原子(${\;}_{1}^{2}$H)说法错误的是( )| A. | 氘原子核外有1个电子 | B. | 氘原子质量数为2 | ||
| C. | 一个氘原子中含有2个中子 | D. | 与氕原子互为同位素 |
分析 H元素有三种H原子,分别为1H、2H、3H.即2H是氢元素的一种氢原子,故质子数为1,电子数为1,中子数为1,故质量数为2.和1H、3H互为同位素,据此分析.
解答 解:A、氘原子属于氢元素,故核外有1个电子,故A正确;
B、氘原子的质子数为1,中子数为1,故质量数为2,故B正确;
C、一个氘原子的核内有1个中子,故C错误;
D、氕、氘和氚是氢元素的三种氢原子,故互为同位素,故D正确.
故选C.
点评 本题考查了互为同位素的原子间的关系和质子数、中子数以及质量数的有关计算,难度不大,注意掌握基础.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
15. 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
16.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L的CH3Cl中所含质子数为26NA | |
| B. | 将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA | |
| C. | 常温下,1L0.1mol/L醋酸中含有的离子总数为0.2NA | |
| D. | 0.1molC2H2气体中,原子间含有的共用电子对数目为0.3NA |
13.下列实验装置能达到相应实验目的是( )
| A. | 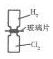 利用如图装置可将H2和Cl2均匀混合 | |
| B. | 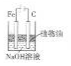 利用如图装置可以制备能较长时间存在的Fe(OH)2沉淀 | |
| C. |  利用如图装置加热蒸干NaCl溶液制备NaCl晶体 | |
| D. |  利用如图装置分离苯和甲苯 |
20.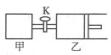 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )| A. | 甲中反应的平衡常数小于乙 | |
| B. | 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态 | |
| C. | 平衡时甲容器中A的物质的量小于0.55 mol | |
| D. | 若打开活塞K,达平衡时乙容器的体积为3.2 L |
10.将表面有氧化膜的铝片伸入足量的NaOH溶液中,有关离子方程式正确的是( )
| A. | Al2O3+OH-→AlO2-+H2O | B. | 2Al3++6OH-→2Al(OH)3↓ | ||
| C. | 2Al+2OH-+2H2O→2AlO2-+3H2↑ | D. | 2Al+6H2O→2Al3++6OH-+3H2↑ |
1.设NA代表阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标准状况下,11.2L的O2和NO的混合物含有的分子数为0.5NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 在一定条件下,2mol浓H2SO4与足量的铜充分反应,转移的电子数目为2NA |
18.某同学将金属钠露置于空气中,观察到下列现象:银白色$\stackrel{①}{→}$变灰暗$\stackrel{②}{→}$变白色$\stackrel{③}{→}$出现液滴$\stackrel{④}{→}$白色晶体$\stackrel{⑤}{→}$白色粉末,根据钠及其化合物的性质分析,下列说法正确的是( )
| A. | ①发生了氧化还原反应 | |
| B. | ①变灰暗是因为生成了过氧化钠 | |
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 | |
| D. | ④⑤只发生物理变化 |
19.设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |