题目内容
19.设NA表示阿伏加德罗常数的值,下列说法错误的是( )| A. | 1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
分析 A、HCO3-在溶液中既能电离为CO32-,又能水解为H2CO3;
B、CO2、N2O的摩尔质量均为44g/mol,且均含3个原子;
C、氢气中不含中子;
D、氧气和钠反应后可能变为-2价,还可能变为-1价.
解答 解:A、HCO3-在溶液中既能部分电离为CO32-,又部分能水解为H2CO3,故溶液中的HCO3-、CO32-、H2CO3的个数之和为0.1NA个,故A错误;
B、CO2、N2O的摩尔质量均为44g/mol,故44g混合物的物质的量为1mol,且两者均含3个原子,故1mol混合物中含3NA个原子,故B正确;
C、氢气中不含中子,故36g氢气中含有的中子的个数为0,故C错误;
D、标况下2.24L氧气的物质的量为0.1mol,而氧气和钠反应后可能变为-2价,还可能变为-1价.若0.1mol氧气反应后全部变为-2价,则转移0.4mol电子;若0.1mol氧气反应后全部变为-1价,则转移0.2mol电子,现在由于氧气反应后的产物不明确,故转移的电子的范围为0.2mol≤n≤0.4mol,故可能为0.3NA个,故D正确.
故选BD.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
5.重水(${\;}_{1}^{2}$H2O)是重要的核工业原料,关于氘原子(${\;}_{1}^{2}$H)说法错误的是( )
| A. | 氘原子核外有1个电子 | B. | 氘原子质量数为2 | ||
| C. | 一个氘原子中含有2个中子 | D. | 与氕原子互为同位素 |
10.下列反应中,熵显著增加的是( )
| A. | CO(g)+2H2(g)=CH3OH(g) | |
| B. | CaCO3(g)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g) | |
| C. | C(s)+O2(g)=CO2(g) | |
| D. | 2Hg(l)+O2(g)=2HgO(s) |
7.已知下列物质的溶度积常数如下表:
下列沉淀可能溶解于盐酸的是( )
| 物质 | HgS | Ag2S | MnS | CuS |
| 溶度积常数 | 6.4×10-53 | 6.3×10-50 | 2.5×10-13 | 1.3×10-36 |
| A. | HgS | B. | Ag2S | C. | MnS | D. | CuS |
14.若金属钠引起火灾,则下列物质或方法中可用于灭火的是( )
| A. | 水 | B. | 湿布 | C. | 干砂 | D. | 泡沫灭火器 |
4.下列有关物质的保存方法不正确的是( )
| A. | 浓氨水、浓硝酸应保存在棕色试剂瓶中,并置于阴凉处 | |
| B. | 液溴易挥发,应保存在棕色试剂瓶中,并加水封 | |
| C. | 在储存铵态化肥时,应密封包装并放在阴凉通风处 | |
| D. | 碘易升华,应保存在棕色细口瓶中,并置于阴凉处 |
11.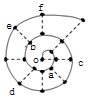 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
9.常温下,氨水与硫酸铵的混合液pH=7时,c(SO42-)与 c(NH4+)之比为( )
| A. | 等于1:2 | B. | 小于1:2 | C. | 等于2:1 | D. | 大于2:1 |