题目内容
15. 常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )
常温下,向10mLmol•L-1HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图.下列说法不正确的是( )| A. | 常温下,电离平衡常数Ka(HR)≈Kb(NH3•H2O) | |
| B. | b点溶液pH=7,此时HR溶液与氨水恰好完全反应 | |
| C. | c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+) | |
| D. | a、b、c三点中,c点NH3•H2O的电离程度最大 |
分析 A.b点导电性最强,此时溶液pH=7,是加入10mLHR,HR与一水合氨的浓度、体积相等,则二者恰好反应;
B.氨水与HR的物质的量关系判断;
C.c点时溶液的pH>7,混合液显示碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-);
D.NH3•H2O浓度越大,电离程度越小.
解答 解:A.通过图象分析可知b点是导电能力最大,此时溶液pH=7,是HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,铵根离子与R-的水解程度相等,所以电离平衡常数Ka(HR)≈Kb(NH3•H2O),故A正确;
B.b点HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,故B正确;
C.根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),所以c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+),故C正确;
D.NH3•H2O浓度越大,电离程度越小,所以随着加入的氨水增多,氨水的电离程度减小,所以a点NH3•H2O的电离程度最大,故D错误;
故选D.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较、溶液导电性及其影响等知识,题目难度中等,明确酸碱混合的定性判断及溶液酸碱性与溶液pH的计算方法为解答关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.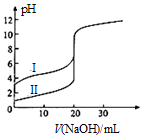 25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
 25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | V(NaOH)=20.00mL时,两溶液中 c(CH3COO-)>c(Cl-) |
6.新一代饮用水的消毒剂ClO2具有高效、广谱、安全等特点.制取ClO2的其中一种反应是:Cl2+2NaClO2═2ClO2+2NaCl.则下列叙述正确的是( )
| A. | 该反应是复分解反应 | B. | 该反应1molCl2得到2mole- | ||
| C. | 反应中Cl2既是氧化剂,又是还原剂 | D. | NaClO2和ClO2中Cl的化合价相同 |
3.下列各组反应,最终一定能得到白色沉淀的是( )
| A. | 向 Al2 (SO4 )3溶液中加入过量 NaOH 溶液 | |
| B. | 向 CuSO4 溶液中加入 NaOH 溶液 | |
| C. | 向 FeCl2 溶液中加入过量 NaOH 溶液 | |
| D. | 向 Na2SiO3溶液中加入稀盐酸 |
20.在25℃时,下列各种情况下一定能大量共存的离子组为( )
| A. | pH=7的溶液中:Fe3+、Cl-、Na+、NO3- | |
| B. | 由水电离出的c(H+)=1×10-13 mol•L-1的水溶液中Na+、CO32-、Cl-、K+ | |
| C. | 无色透明的酸性溶液中NH4+、NO3-、Al3+、Cl- | |
| D. | Al3+、HCO3-、I-、Ca2+ |
7.分子组成为C6HmO3N3Cl的有机物分子中,m最大值为( )
| A. | 14 | B. | 16 | C. | 18 | D. | 20 |
4.利用反应:B(OCH3)3+4NaH=NaBH4+3CH3ONa制备NaBH4.下列说法不正确的是( )
| A. | NaBH4的电子式为 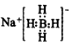 | |
| B. | 该反应在无水环境中进行 | |
| C. | NaBH4是很好的还原剂,常用于有机合成 | |
| D. | 1 molNaBH4与水充分反应可生成标况下44.8LH2 |
5.重水(${\;}_{1}^{2}$H2O)是重要的核工业原料,关于氘原子(${\;}_{1}^{2}$H)说法错误的是( )
| A. | 氘原子核外有1个电子 | B. | 氘原子质量数为2 | ||
| C. | 一个氘原子中含有2个中子 | D. | 与氕原子互为同位素 |