题目内容
18.某同学将金属钠露置于空气中,观察到下列现象:银白色$\stackrel{①}{→}$变灰暗$\stackrel{②}{→}$变白色$\stackrel{③}{→}$出现液滴$\stackrel{④}{→}$白色晶体$\stackrel{⑤}{→}$白色粉末,根据钠及其化合物的性质分析,下列说法正确的是( )| A. | ①发生了氧化还原反应 | |
| B. | ①变灰暗是因为生成了过氧化钠 | |
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 | |
| D. | ④⑤只发生物理变化 |
分析 小块金属钠露置于空气中发生的变化中,银白色$\stackrel{①}{→}$变灰暗$\stackrel{②}{→}$变白色$\stackrel{③}{→}$出现液滴$\stackrel{④}{→}$白色晶体$\stackrel{⑤}{→}$白色粉末,①是钠被氧化为氧化钠;②是氧化钠和水反应生成氢氧化钠;③氢氧化钠潮解形成氢氧化钠溶液;④是二氧化碳和氢氧化钠反应生成碳酸钠晶体,⑤生成碳酸钠固体,以此解答该题.
解答 解:A.Na的性质活泼,易与空气中氧气反应生成Na2O,故A正确;
B.①变灰暗色是因为生成了氧化钠,故B错误;
C.③是氢氧化钠潮解,吸收水蒸气形成氢氧化钠溶液,故C错误;
D.④是二氧化碳和氢氧化钠反应生成碳酸钠晶体,⑤发生晶体的风化,生成碳酸钠固体,都为化学变化,故D错误.
故选A.
点评 本题考查钠与氧气反应的性质,题目难度不大,本题注意相关基础知识的积累,注意钠在加热条件下能在空气中燃烧,但不加热时,生成氧化钠.

练习册系列答案
相关题目
4.利用反应:B(OCH3)3+4NaH=NaBH4+3CH3ONa制备NaBH4.下列说法不正确的是( )
| A. | NaBH4的电子式为 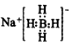 | |
| B. | 该反应在无水环境中进行 | |
| C. | NaBH4是很好的还原剂,常用于有机合成 | |
| D. | 1 molNaBH4与水充分反应可生成标况下44.8LH2 |
5.重水(${\;}_{1}^{2}$H2O)是重要的核工业原料,关于氘原子(${\;}_{1}^{2}$H)说法错误的是( )
| A. | 氘原子核外有1个电子 | B. | 氘原子质量数为2 | ||
| C. | 一个氘原子中含有2个中子 | D. | 与氕原子互为同位素 |
6.向体积相同的MgSO4、CuSO4、Fe2(SO4)3溶液加入物质的量浓度相同的NaOH溶液,恰好完全反应,若消耗NaOH溶液的体积比为3:2:1,则上述三种溶液的物质的量浓度之比为( )
| A. | 9:6:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
13.已知AgCl、AgBr及AgI的ksp依次为Ksp依次为1.6×10-10、4.8×10-13、1.6×10-16.现将物质的量均为1.5×10-2mol的NaI、NaBr、NaCl和molAgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol•L-1 | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol•L-1 | D. | 溶液中c(Ag+)≈3.2×10-8mol•L-1 |
3.下列说法中,正确的是( )
| A. | 乙烷、乙烯、乙炔都难溶于水,且密度比水小 | |
| B. | 可用溴水来鉴别乙烷、乙烯和乙炔三种无色气体 | |
| C. | 在一定条件下,乙烷、乙烯、乙炔都能与氯气发生同类型反应 | |
| D. | 乙烷、乙烯、乙炔都能发生加聚反应生成高分子化合物 |
10.下列反应中,熵显著增加的是( )
| A. | CO(g)+2H2(g)=CH3OH(g) | |
| B. | CaCO3(g)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g) | |
| C. | C(s)+O2(g)=CO2(g) | |
| D. | 2Hg(l)+O2(g)=2HgO(s) |
7.已知下列物质的溶度积常数如下表:
下列沉淀可能溶解于盐酸的是( )
| 物质 | HgS | Ag2S | MnS | CuS |
| 溶度积常数 | 6.4×10-53 | 6.3×10-50 | 2.5×10-13 | 1.3×10-36 |
| A. | HgS | B. | Ag2S | C. | MnS | D. | CuS |