题目内容
13.下列实验装置能达到相应实验目的是( )| A. | 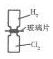 利用如图装置可将H2和Cl2均匀混合 | |
| B. | 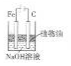 利用如图装置可以制备能较长时间存在的Fe(OH)2沉淀 | |
| C. |  利用如图装置加热蒸干NaCl溶液制备NaCl晶体 | |
| D. |  利用如图装置分离苯和甲苯 |
分析 A.氯气的密度比氢气的密度大,偏于混合应在上方;
B.Fe与电源正极相连,为阳极,阴极上氢离子得到电子;
C.蒸干NaCl溶液,选择蒸发皿;
D.冷凝管应选直形冷凝管.
解答 解:A.氯气的密度比氢气的密度大,偏于混合应在上方,则图中气体的位置不合理,故A错误;
B.Fe与电源正极相连,为阳极,阴极上氢离子得到电子,生成氢气将空气排出,且防止氢氧化亚铁被氧化,故B正确;
C.蒸干NaCl溶液,选择蒸发皿,不能使用坩埚,故C错误;
D.冷凝管应选直形冷凝管,不能导致馏分暂留,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、电化学、混合物分离及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
3.下列各组反应,最终一定能得到白色沉淀的是( )
| A. | 向 Al2 (SO4 )3溶液中加入过量 NaOH 溶液 | |
| B. | 向 CuSO4 溶液中加入 NaOH 溶液 | |
| C. | 向 FeCl2 溶液中加入过量 NaOH 溶液 | |
| D. | 向 Na2SiO3溶液中加入稀盐酸 |
4.利用反应:B(OCH3)3+4NaH=NaBH4+3CH3ONa制备NaBH4.下列说法不正确的是( )
| A. | NaBH4的电子式为 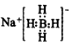 | |
| B. | 该反应在无水环境中进行 | |
| C. | NaBH4是很好的还原剂,常用于有机合成 | |
| D. | 1 molNaBH4与水充分反应可生成标况下44.8LH2 |
1.甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是( )

| A. | 甲为C2H5OH、X为O2 | B. | 甲为H2S、X为O2 | ||
| C. | 甲为HNO3、X为Fe | D. | 甲为AlCl3溶液、X为NaOH溶液 |
18.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 铝粉与WO3共热制备金属钨 | B. | 高温下CO还原Fe2O3制备铁 | ||
| C. | 铁粉与水蒸气加热制备氢气 | D. | Ca( OH)2与NH4Cl加热制备氨气 |
5.重水(${\;}_{1}^{2}$H2O)是重要的核工业原料,关于氘原子(${\;}_{1}^{2}$H)说法错误的是( )
| A. | 氘原子核外有1个电子 | B. | 氘原子质量数为2 | ||
| C. | 一个氘原子中含有2个中子 | D. | 与氕原子互为同位素 |
6.向体积相同的MgSO4、CuSO4、Fe2(SO4)3溶液加入物质的量浓度相同的NaOH溶液,恰好完全反应,若消耗NaOH溶液的体积比为3:2:1,则上述三种溶液的物质的量浓度之比为( )
| A. | 9:6:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
7.已知下列物质的溶度积常数如下表:
下列沉淀可能溶解于盐酸的是( )
| 物质 | HgS | Ag2S | MnS | CuS |
| 溶度积常数 | 6.4×10-53 | 6.3×10-50 | 2.5×10-13 | 1.3×10-36 |
| A. | HgS | B. | Ag2S | C. | MnS | D. | CuS |
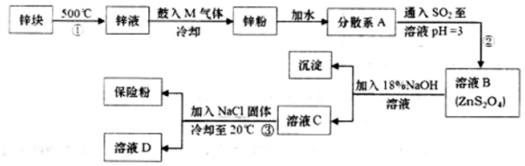
 ;悬浊液; (填“溶液”“胶体”或“悬浊液”).
;悬浊液; (填“溶液”“胶体”或“悬浊液”).