题目内容
1.设NA代表阿伏伽德罗常数,下列叙述正确的是( )| A. | 标准状况下,11.2L的O2和NO的混合物含有的分子数为0.5NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 在一定条件下,2mol浓H2SO4与足量的铜充分反应,转移的电子数目为2NA |
分析 A、O2和NO混合后发生反应生成NO2,导致分子个数减少;
B、羟基中含9个电子,而氢氧根中含10个电子;
C、氮气和CO的摩尔质量均为28g/mol,且均为双原子分子;
D、铜只能和浓硫酸发生反应,和稀硫酸不反应.
解答 解:A、O2和NO混合后发生反应生成NO2,导致分子个数减少,且NO2气体中存在向四氧化二氮转化的平衡,故导致最终分子个数小于0.5NA个,故A错误;
B、羟基中含9个电子,而氢氧根中含10个电子,故1mol氢氧根中含10NA个电子,故B错误;
C、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且两者均为双原子分子,故0.5mol混合物中含有的原子个数为NA个,故C正确;
D、铜只能和浓硫酸发生反应,和稀硫酸不反应,即浓硫酸不能反应完全,则转移的电子数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
7.分子组成为C6HmO3N3Cl的有机物分子中,m最大值为( )
| A. | 14 | B. | 16 | C. | 18 | D. | 20 |
5.重水(${\;}_{1}^{2}$H2O)是重要的核工业原料,关于氘原子(${\;}_{1}^{2}$H)说法错误的是( )
| A. | 氘原子核外有1个电子 | B. | 氘原子质量数为2 | ||
| C. | 一个氘原子中含有2个中子 | D. | 与氕原子互为同位素 |
12.可测出某84消毒液的pH为10.2是( )
| A. | pH试纸 | B. | 红色石蕊试纸 | ||
| C. | 数字pH计 | D. | 以酚酞为指示剂进行酸碱中和滴定 |
6.向体积相同的MgSO4、CuSO4、Fe2(SO4)3溶液加入物质的量浓度相同的NaOH溶液,恰好完全反应,若消耗NaOH溶液的体积比为3:2:1,则上述三种溶液的物质的量浓度之比为( )
| A. | 9:6:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
13.已知AgCl、AgBr及AgI的ksp依次为Ksp依次为1.6×10-10、4.8×10-13、1.6×10-16.现将物质的量均为1.5×10-2mol的NaI、NaBr、NaCl和molAgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol•L-1 | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol•L-1 | D. | 溶液中c(Ag+)≈3.2×10-8mol•L-1 |
10.下列反应中,熵显著增加的是( )
| A. | CO(g)+2H2(g)=CH3OH(g) | |
| B. | CaCO3(g)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g) | |
| C. | C(s)+O2(g)=CO2(g) | |
| D. | 2Hg(l)+O2(g)=2HgO(s) |
11.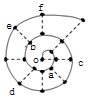 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
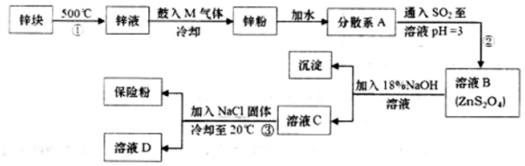
 ;悬浊液; (填“溶液”“胶体”或“悬浊液”).
;悬浊液; (填“溶液”“胶体”或“悬浊液”).