题目内容
19. Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
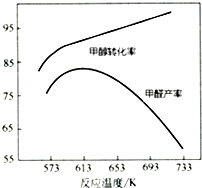
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
分析 I.(1)由物质燃烧热数据可知:①CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ•mol-1,
②HCHO(g)+O2(g)=CO2(g)+H2O(l)△H=-570.8 kJ•mol-1,
根据盖斯定律,①-②可得:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l),据此计算;
(2)反应的转化率较大,甲醛可被氧化生成CO和水;
(3)反应催化剂的活性与温度有关,较高温度时甲醇的转化率较高,但生成的甲醛存在副反应;
Ⅱ.(4)甲醇在负极被氧化生成二氧化碳和水;
(5)甲醇被氧化生成二氧化碳,C的化合价由-2价升高到+4甲,1mol失去6mol电子,额定输出电压为1.18V,可计算输出能量,结合反应热计算能量转化率.
解答 解:I.(1)由物质燃烧热数据可知:①CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ•mol-1,
②HCHO(g)+O2(g)=CO2(g)+H2O(l)△H=-570.8 kJ•mol-1,
根据盖斯定律,①-②可得:CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H=-726.5kJ•mol-1-(-570.8 kJ•mol-1)=-155.7kJ•mol-1;
故答案为:-155.7kJ•mol-1;
(2)反应的转化率较大,甲醛可被氧化生成CO和水,存在副反应,故答案为:反应平衡常数大,反应更彻底,但是存在副反应;
(3)反应催化剂的活性与温度有关,反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低,较高温度时甲醇的转化率较高,但生成的甲醛存在副反应,产率反而下降,
故答案为:反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降;
(4)甲醇在负极被氧化生成二氧化碳和水,电极方程式为CH3OH-6e-+H2O═CO2+6H+,故答案为:CH3OH-6e-+H2O═CO2+6H+;
(5)甲醇被氧化生成二氧化碳,C的化合价由-2价升高到+4甲,1mol失去6mol电子,额定输出电压为1.18V,则输出能量为6mol×96500 C•mol-1×1.18V=683220J,而反应热为726.5×103 J,则转化率为$\frac{683220}{726.5×1{0}^{3}}×100%$=94.1%,
故答案为:94.1%.
点评 本题考查较为综合,涉及反应热与焓变、化学平衡的移动以及原电池知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,易错点为(5),注意计算的思路和方法.

| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | H+、Mg2+、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
(1)氨催化氧化法是工业制硝酸的主要方法.已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9 kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-905.0 kJ/mol.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4 kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是AB(填字母).
A.由图1可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)电化学法是合成氨的一种新方法,其原理如图2所示,通入H2的一极为阳极(填“阴极”或“阳极”),阴极得电极反应式是N2+6H++6e-=2NH3.
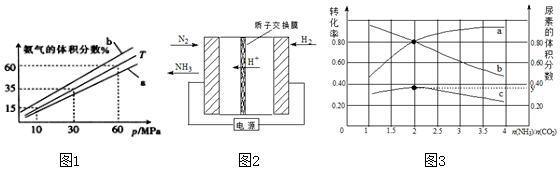
(5)氨碳比[$\frac{n(N{H}_{3})}{C{O}_{2}}$]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响,T℃时,在一体积为2L地 恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图3所示,a,b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数,$\frac{n(N{H}_{3})}{C{O}_{2}}$=2时,尿素的产量最大;该条件下反应的平衡常数K=40.
方法 I:丙烷脱氢制丙烯:
①C3H8(g)$?_{△}^{催化剂}$ C3H6(g)+H2(g)△H1
方法 II:丙烷氧化脱氢制丙烯:(投料为C3H8和CO2)
②C3H8(g)+CO2(g) $?_{△}^{催化剂}$ C3H6(g)+CO(g)+H2O(g)△H2=165kJ•mol-1
③CO2(g)+H2(g) $?_{△}^{催化剂}$ CO(g)+H2O(g)△H3=41kJ•mol-1
已知:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
(2)模拟方法 I制丙烯,在体积可变的反应器中,恒温,维持体系总压强恒定为0.1MPa,加入1mol C3H8(g)时体积为50L,再加入8.5mol水蒸汽作为稀释剂,反应t分钟达到平衡,测得丙烷0.5mol,已知:分压=物质的量分数×总压强.
①计算该温度下反应I的平衡常数K=0.005MPa(KP)或0.001(KC).
②常压下,温度为600K~1000K,水烃比M=10(水烃比是指投料中水蒸汽和丙烷的物质的量之比)时丙烷脱氢平衡转化率与温度变化的曲线如图1,在图1中画出水烃比M=8时的曲线.
(3)模拟方法 II制丙烯,在恒温恒容条件下充入物质的量之比为1:1的丙烷和二氧化碳气体,一段时间后达到平衡,则下列可以判断容器内反应体系达到平衡的是AB.
A.v正(C3H8)=v逆(C3H6) B.平均相对分子质量不再变化
C.气体密度不再变化 D.丙烷和二氧化碳的物质的量比值不再变化
(4)在相同条件下模拟方法 I与方法 II,测得丙烷的平衡转化率与温度的关系如图2所示,图2中方法 II对应的曲线是M(填“M”或“N”),从化学平衡的角度解释丙烷平衡转化率M高于N的原因方法 II 可看成是发生反应①和反应③,由于反应③会消耗氢气,使得反应①的化学平衡向右移动.
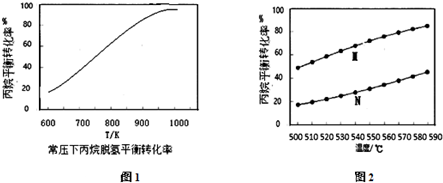
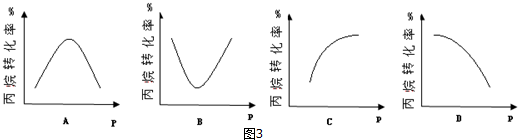
(5)恒温,密闭容器中投入丙烷发生反应①,某压强下反应t时刻后测得丙烷的转化率,然后保持其它初始实验条件不变,分别在不同压强下,重复上述实验,经过相同时间测得丙烷的转化率随压强变化趋势图可能图3中的是ACD.
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)、△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如表所示
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的自发性可能自发(填“一定自发”、“可能自发”或“一定不自发”);反应Ⅱ的平衡常数表达式为$\frac{c({H}_{2}O)•c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ的△H3和△H1、△H2的关系△H3=2×△H1+△H2反应.
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为5.0MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是43.75%.

(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是增大生成物C浓度或升高温度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在上图中画出t4-t6的变化曲线.
 .
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.