题目内容
1.下列事实中不能用平衡移动原理解释是( )| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A.氨水中存在NH3+H2O?NH3.H2O?NH4++OH-,一水合氨不稳定,升高温度易分解,所以需要密封、低温保存,可以用勒夏特里原理解释,故A不选;
B.氯气和水反应存在Cl2+H2O?HCl+HClO,食盐水中含有氯离子抑制氯气溶解,所以可以采用排饱和食盐水的方法收集氯气,可以用勒夏特里原理解释,故B不选;
C.因溶液中存在二氧化碳的溶解平衡,打开汽水瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故C不选;
D.催化剂只改变化学反应速率不影响平衡移动,所以不能用平衡移动原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,为高频考点,只有能引起平衡移动的条件才能用平衡移动原理解释,注意平衡移动原理适用范围,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
12.在蒸发皿中将下列盐溶液蒸干并灼烧,能得到该物质的固体的是( )
| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 亚硫酸钠 |
9.下列各溶液中一定能大量共存的离子组是( )
| A. | 使酚酞试液呈红色的溶液中:K+、Na+、SO42-、NO3- | |
| B. | 使pH试纸呈红色的溶液中:Fe3+、Na+、SCN-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、AlO2-、SO42-、NO3- | |
| D. | 加入Al粉能产生H2的溶液中:K+、Na+、AlO2-、CO32- |
16.已知:
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
①2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
②Cl2+2FeCl2═2FeCl3;
③2KI+2FeCl3═2KCl+I2+2FeCl2.
则下列判断正确的是( )
| A. | 氧化性:MnO4-<Cl2<Fe3+<I2 | |
| B. | 还原性:Fe2+>I->Cl- | |
| C. | FeCl3能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 反应①中只体现盐酸的还原性 |
6.在某无色透明的酸性溶液中,能共存的离子组是( )
| A. | Na+K+ SO42- HCO3- | B. | Cu2+ K+ SO42- NO3- | ||
| C. | Na+ K+ Cl- NO3- | D. | Al3+ K+ SO42-OH- |
13.在100mL2mol/L的盐酸反应中分别加入等物质的量的金属Na、Mg、Al,充分生成气体的体积均为VL(标准状况下),下列说法正确的是( )
| A. | 反应中,每生成1molH2转移的电子数均为2mol | |
| B. | 参加反应的金属Na、Mg、Al的物质的量之比为1:2:3 | |
| C. | 镁的物质的量为0.1mol | |
| D. | V=2.24 |
19.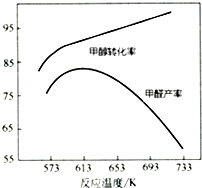 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
(1)计算△H=-155.7kJ•mol-1.
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)