题目内容
11.已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)(l)请回答下列问题:
①该反应的生成物能量总和小于(填“大于”、“小于”或“等于”)反应物能量总和.
②若2mol氢气完全燃烧生成水蒸气,则放出的热量<(填“>”、“<”或“=”)572kJ.
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点热值高,无污染.
分析 (1)①根据放热反应中生成物能量总和与反应物能量总和的关系;
②根据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol进行计算以及液态水变成水蒸气需要吸热来判断;
③根据反应产物和反应热分析.
解答 解:(1)①因放热反应中生成物能量总<与反应物能量总和,而2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol是放热反应,
故答案为:小于;
②据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol,2mol氢气完全燃烧生成液态水放出热量572kJ,因液态水变成水蒸气需要吸热,所以2mol氢气完全燃烧生成水蒸气放出热量小于572kJ,
故答案为:<;
③与化石燃料相比,利用氢能源有很多优点,燃烧产物为水无污染,燃烧热值高;
故答案为:热值高,无污染.
点评 本题考查了化学反应的吸放热于反应物产物能量之间的关系,注意知识的整理和应用是关键,难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
13.在100mL2mol/L的盐酸反应中分别加入等物质的量的金属Na、Mg、Al,充分生成气体的体积均为VL(标准状况下),下列说法正确的是( )
| A. | 反应中,每生成1molH2转移的电子数均为2mol | |
| B. | 参加反应的金属Na、Mg、Al的物质的量之比为1:2:3 | |
| C. | 镁的物质的量为0.1mol | |
| D. | V=2.24 |
19.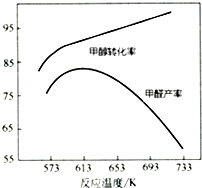 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
(1)计算△H=-155.7kJ•mol-1.
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
 Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).
Ⅰ.工业上主要以甲醇为原料进行制备甲醛(HCHO).甲醇氧化法是制甲醛的一种工业方法,即甲醇蒸汽和空气在铁钼催化剂催化下,甲醇即被氧化得到甲醛:①CH3OH(g)+$\frac{1}{2}$O2(g)═HCHO(g)+H2O(l)△H
甲醇氧化法中存在深度氧化反应:②HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(l)
已知物质CH3OH(g)与HCHO(g)的燃烧热如表所示:
| 物质 | 反应热/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
(2)目前工业上主要采用甲醇氧化法制取甲醛,简要分析该方法的优点与缺点:反应平衡常数大,反应更彻底,但是存在副反应.
(3)如图为甲醇氧化法,在不同温度条件下甲醇转化率与甲醛产率的曲线图,二者随温度变化的可能的原因是反应温度较低时催化剂活性较低,甲醇转化率低,甲醛产率较低;反应温度升高后,甲醇转化率提高,但是发生副反应,产率反而下降.
Ⅱ.甲醇直接燃料电池简称DMFC,使用酸性介质,反应温度在120℃,额定输出电压为1.18V.
(4)该电池负极的电极反应式为CH3OH-6e-+H2O═CO2+6H+,
(5)该燃料电池的能量转换效率=94.1%(列式并计算,保留3位有效数字)
(已知:能量转换效率=燃料电池输出的电能/燃料直接燃烧产生的热能;1mol 电子的电量为96500C.)
16.甲醇是重要的化工原料.利用合成气(主要成分CO,CO2和H2)在催化剂的作用下合成甲醇,发生主要反应如下:
?CO(g)+2H2(g)?CH3OH(g)?CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
甲醇与CO的结构式分别如图:
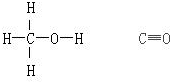
(1)已知反应?中相关化学键键能数据如表:
利用反应?合成1mol甲醇反应放出(填“放出”或“吸收”)能量99kJ
(2)温度为110℃条件下,向体积2L的密闭容器充2molCO2与4molH2,发生反应?,10min后达到平衡状态后测得甲醇浓度为0.5mol.L-1.求氢气的反应速率:0.15mol/(L•min).
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题: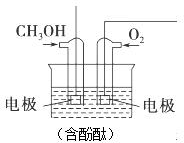
通入甲醇的电极是负(填“正”或“负”)极,反应时该电极附近的现象是溶液红色变浅,溶液中K+向正(填“正”或“负”)极移动:写出正极反应式:O2+2H2O+4e-=4OH-;若电池工作过程中通过2mol电子,则理论上消耗O211.2L(标准状况).
?CO(g)+2H2(g)?CH3OH(g)?CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
甲醇与CO的结构式分别如图:
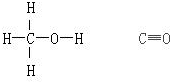
(1)已知反应?中相关化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)温度为110℃条件下,向体积2L的密闭容器充2molCO2与4molH2,发生反应?,10min后达到平衡状态后测得甲醇浓度为0.5mol.L-1.求氢气的反应速率:0.15mol/(L•min).
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:

通入甲醇的电极是负(填“正”或“负”)极,反应时该电极附近的现象是溶液红色变浅,溶液中K+向正(填“正”或“负”)极移动:写出正极反应式:O2+2H2O+4e-=4OH-;若电池工作过程中通过2mol电子,则理论上消耗O211.2L(标准状况).
3.下列图示与对应的叙述相符的是( )
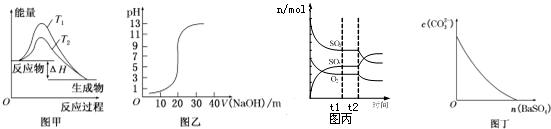

| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)浓度变化 |
 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1